Contexte Le rimonabant, un antagoniste sélectif des
récepteurs cannabinoïdes de type 1, peut entraîner une
réduction du poids et une amélioration des facteurs de risque
cardio-métaboliques chez les patients obèses ou en surpoids.
Objectif Comparer l'efficacité et la sécurité
d'emploi du rimonabant avec celles d'un placebo, en association dans les 2 cas
avec un régime et de l'exercice physique, au cours d'une
évaluation sur une période de 2 ans des modifications du poids
et des facteurs de risque cardio-métaboliques.
Plan expérimental, cadre et participants Essai
contrôlé contre placebo, randomisé, en double aveugle,
effectué chez 3 045 patients adultes obèses (indice de masse
corporelle 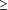 30) ou en surpoids (indice de masse corporelle > 27 et
hypertension artérielle ou dyslipidémie traitée ou non
traitée) dans 64 centres de recherche clinique américains et 8
centres de recherche clinique canadiens entre août 2001 et avril
2004.
30) ou en surpoids (indice de masse corporelle > 27 et
hypertension artérielle ou dyslipidémie traitée ou non
traitée) dans 64 centres de recherche clinique américains et 8
centres de recherche clinique canadiens entre août 2001 et avril
2004.
Intervention Après une phase de préinclusion en simple
aveugle de 4 semaines durant laquelle les patients étaient sous placebo
et régime (déficit de 600 kilocalories/jour), il leur
était attribué par randomisation soit un placebo, soit 5 mg/jour
de rimonabant, soit 20 mg/jour de rimonabant, pour une durée de 1 an.
La deuxième année, alors que le groupe placebo continuait
à recevoir le placebo, les patients traités par rimonabant
recevaient, après une nouvelle randomisation, soit un placebo soit la
même dose de rimonabant.
Principaux critères de jugement Modification du poids durant
l'année 1 et prévention de la reprise de poids durant
l'année 2. L'efficacité a également été
évaluée par les modifications survenues au niveau du
périmètre abdominal, des taux de lipides plasmatiques et des
autres facteurs de risque cardio-métaboliques.
Résultats À 1 an, le taux d'observance était de
51 % (309 patients) dans le groupe placebo, de 51 % (620 patients) dans le
groupe rimonabant 5 mg et de 55 % (673 patients) dans le groupe rimonabant 20
mg. Dans le groupe rimonabant 20 mg comparé au groupe placebo, les
réductions moyennes obtenues (erreur type de la moyenne) ont
été plus importantes pour le poids (-6,3 [0,2] kg vs
-1,6 [0,2] kg; p < 0,001), le périmètre abdominal
(-6,1 [0,2] cm vs -2,5 [0,3] cm; p < 0,001) et le taux de
triglycérides (modification en pourcentage: -5,3 [1,2] vs 7,9
[2,0]; p < 0,001) et l'augmentation obtenue dans le taux de
cholestérol HDL a été plus importante (modification en
pourcentage: 12,6 [0,5] vs 5,4 [0,7]; p < 0,001). Les
patients qui sont passés du groupe rimonabant 20 mg au groupe placebo
au cours de l'année 2 ont eu une reprise de poids tandis que ceux qui
continuaient à recevoir 20 mg de rimonabant maintenaient leur perte de
poids et les modifications favorables obtenues au niveau des facteurs de
risque cardio-métaboliques. Les différentes méthodes de
traitement des données utilisées pour tenir compte des taux
élevés d'abandon dans les 3 groupes ont donné des
résultats similaires. Le rimonabant a été
généralement bien toléré; les nausées ont
été l'événement indésirable lié
à la prise du médicament le plus fréquent (11,2 % dans le
groupe rimonabant 20 mg vs 5,8 % dans le groupe placebo).
Conclusions Dans cet essai multicentrique, un traitement de
rimonabant, à la dose de 20 mg/jour, accompagné d'un
régime durant 2 ans a permis d'obtenir des réductions modestes
mais persistantes du poids et du périmètre abdominal ainsi que
des modifications favorables des facteurs de risque
cardio-métaboliques. Cependant, cet essai est limité par un taux
élevé d'abandon et des études complémentaires sont
nécessaires pour évaluer les effets à long terme du
médicament.
Enregistrement des essais cliniques Numéro d'identification
ClinicalTrials.gov Identifier:
NCT00029861.
JAMA. 2006;295:761-775.