 |
 |

Chlorproguanil-dapsone ou chloroquine dans le traitement du paludisme à Plasmodium vivax en Afghanistan et au PakistanUn essai contrôlé, randomisé
Toby Leslie, MSc;
M. Ismail Mayan, MD;
M. Anwar Hasan, MD;
M. Hanif Safi;
Eveline Klinkenberg, PhD;
Christopher J. M. Whitty, FRCP;
Mark Rowland, PhD
RÉSUMÉ
 |  |
Contexte Dans des zones où le Plasmodium falciparum et le
Plasmodium vivax coexistent et où le traitement est spécifique
d'une espèce, un mauvais diagnostic peut conduire à des issues
défavorables dans un cas ou dans l'autre. Un traitement commun,
efficace contre les deux espèces réduirait la dépendance
à la spécificité du diagnostic, qui dans certaines zones,
peut être difficile à maintenir. Les antifolates constituent une
classe importante d'antipaludéens abordables auxquels P vivax est
considéré comme intrinsèquement résistant.
Objectif Evaluer l'efficacité relative et l'innocuité
de deux antifolates sur le paludisme à P vivax et les comparer
séparément à la chloroquine.
Schéma, environnement et patients Un essai ouvert,
randomisé, contrôlé comparant la chloroquine, la
sulfadoxine-pyriméthamine et le chlorproguanil-dapsone dans le
traitement du paludisme à P vivax, mené dans l'est de
l'Afghanistan et le nord-ouest du Pakistan, zones où le paludisme
à P vivax prédomine. Un total de 21 410 patients,
âgés de plus de 3 ans ont été
évalués; 767 patients (315 au Pakistan et 452 en Afghanistan)
ayant un paludisme à P vivax confirmé ont été
inclus et suivis quotidiennement pendant 4 jours, puis toutes les semaines
pendant 28 jours, entre mars 2004 et juin 2006.
Critère d'évaluation principal Elimination totale des
parasites et absence de recrudescence après 14 jours. Les
critères secondaires incluaient l'absence de parasites après 28
jours, l'échec clinique et l'anémie.
Résultats Après 14 jours, seul un patient du groupe
sulfadoxine-pyriméthamine avait des parasites. Après 28 jours,
le taux d'échecs se composait de 2 patients sur 153 (1.3%) du groupe
chloroquine, 5 sur 290 (1.7%) du groupe sulfadoxine-pyriméthamine et 27
sur 272 (9.9%) du groupe chlorproguanil-dapsone. Le chlorproguanil-dapsone
était moins efficace que la sulfadoxine-pyriméthamine (rapport
de cotes ajusté [RCA] 6.4; intervalle de confiance [IC] 95%, 2.4-17.0;
P < 0.01) et la chloroquine (RCA 8.4, IC 95%, 2.0-36.5, P=0.004). La
chloroquine et la sulfadoxine-pyriméthamine ont eu une
efficacité similaire à 28 jours (RCA 1.3, IC 95%, 0.3-7.0,
P=0.73). La chloroquine a éliminé les gamétocytes et les
parasites asexués plus rapidement que la
sulfadoxine-pyriméthamine ou le chlorproguanil-dapsone. Tous les
médicaments ont été bien tolérés.
Conclusion Même si la chloroquine demeure le médicament
de choix, les antifolates sont utilisés efficacement contre le
paludisme à P vivax en Asie du sud. Ces médicaments pourraient
être appropriés pour un traitement commun, très
probablement combinés à d'autres molécules actives,
lorsqu'un diagnostic spécifique des espèces n'est pas
disponible.
Numéro d'enregistrement de l'essai
clinicaltrials.gov
Identifiant: NCT00158561
JAMA.
2007;297:2201-2209
Il y a, selon les estimations, 70 à 80 millions de cas de
paludisme à Plasmodium vivax chaque année, comptant pour plus de
50% des cas de paludisme hors de l'Afrique.1 Rarement fatal, l'infection au P
vivax est néanmoins une cause majeure de morbidité et a un
impact économique à l'échelle individuelle et
nationale.2
Il existe un chevauchement important des zones touchées par P vivax et
P falciparum hors de l'Afrique, les deux coexistant dans la plupart des
régions.3
La chloroquine demeure généralement efficace contre le paludisme
à P vivax, en particulier là où elle échoue contre
P falciparum. Il en résulte une divergence de traitement entre les deux
espèces, avec des traitements combinés, à base
d'artemisinin, recommandés pour les cas de paludismes à P
falciparum. Lorsque les possibilités diagnostiques permettent de
différencier de manière fiable les deux espèces, cette
stratégie à deux médicaments est facile à
maintenir. De même, dans des zones où la quasi-totalité
des cas de paludisme sont dus au P falciparum pharmaco-résistant, et
très peu au P vivax, une stratégie appliquant une
thérapie combinée à base d'artemisinin aurait un rapport
coût-efficacité acceptable.
La mise en œuvre pose cependant des problèmes
considérables lorsque les cas de paludisme à P vivax sont
fortement majoritaires et que les possibilités diagnostiques ne sont
pas suffisamment fiables pour différencier les deux espèces.
C'est le cas de nombreuses régions fortement peuplées de l'Asie
du sud, y compris celles concernées par l'étude; ceci
représente un défi de taille en santé publique.
Jusqu'à récemment, les deux formes de paludisme pouvaient
être traitées avec le même médicament, la
chloroquine, largement disponible et à un coût raisonnable
à la fois dans le secteur publique et le secteur privé. Les
erreurs de diagnostic étaient donc peu susceptibles d'aboutir à
des issues cliniques préjudiciables. Dans une situation où le P
falciparum chloroquine-résistant est largement répandu, un
diagnostic erroné de P vivax en lieu et place d'un P falciparum peut
avoir des issues fatales. Inversement, Si P vivax est diagnostiqué
à tort comme étant du P falciparum, le patient sera
traité avec un traitement combiné à base d'artemisinin,
ce qui, bien que sans risque, est considérablement plus coûteux
sans être pour autant plus efficace.
Les alternatives actuelles incluent l'amélioration du diagnostic
afin que la distinction entre les espèces soit fiable, le traitement du
paludisme par des thérapies combinées à base
d'artemisinin, considérablement plus coûteux que la chloroquine,
ou identifier des alternatives moins coûteuses à la chloroquine,
qui seraient efficaces contre les deux espèces à la fois.
Améliorer le diagnostic dans des régions où les services
de santé sont limités relève d'un défi
considérable; des erreurs de diagnostic peuvent se produire, même
dans les laboratoires bien
équipés.5
Les tests de diagnostic rapide qui permettent de détecter les deux
espèces à la fois, de manière fiable, sont coûteux
et souvent impossible à
obtenir.6 Une
stratégie de traitement du paludisme à P falciparum avec le
même médicament que le paludisme à P vivax dans les
régions d'endémicitaé mixte pourrait donc être plus
aisée à mettre en oeuvre plutôt que de miser sur
l'amélioration du diagnostic, à la condition de maîtriser
les coûts. Un traitement commun simplifierait les protocoles pour les
employés de santé sans formation particulière, agirait
contre les infections multiples et réduirait les risques
associés à une erreur diagnostique. Un traitement commun
susceptible d'être utilisé dans des régions
touchées par la guerre, les conflits, ou les catastrophes naturelles,
serait particulièrement utile dans des situations où les flux de
population peuvent accroître rapidement les taux de transmission ou dans
lesquelles les systèmes de santé publique sont
désorganisés ou complètement inopérants.
Les antifolates constituent une classe importante de médicaments qui
fournissent à l'heure actuelle l'alternative la moins coûteuse
à la chloroquine. Ces médicaments peuvent être
utilisés seuls ou combinés. Depuis les années cinquante,
P vivax est largement considéré comme intrinsèquement
résistant aux antifolates à l'échelle de la classe, du
moins dans des cas de figures où les antifolates sont largement
utilisés.8
Si ceci est vrai, une classe entière de médicaments se
trouverait exclue d'utilisation dans un traitement commun dans de nombreuses
régions du monde. En Asie du Sud-est, des preuves, bien que
limitées, montrent de longue date que le paludisme à P vivax est
résistant à la
sulfadoxine-pyriméthamine,9-11
ce qui peut être associé à des régions où la
sulfadoxine-pyriméthamine est communément
utilisée.12
La résistance du paludisme à P falciparum à la
sulfadoxine-pyriméthamine s'était développée
rapidement dans certaines régions où le taux de transmission est
faible ou modéré (ex: la
Thaïlande).13
Il n'y a pas d'arguments fiables concernant l'efficacité actuelle
des antifolates contre P vivax en Asie du Sud, en particulier pour
l'Afghanistan et ses régions frontalières où le paludisme
à P vivax est prédominant (>90% des cas de paludisme) et les
moyens de diagnostic sont
limités.14-16
L'antifolate le plus couramment utilisé est la
sulfadoxine-pyriméthamine. Plus récemment, le
chlorproguanil-dapsone avait été développé pour
des conditions de faibles
moyens.17 Le
chlorproguanil-dapsone s'était montré efficace contre le
paludisme à P falciparum non compliqué en Afrique, y compris
contre des souches sulfadoxine-pyriméthamine-résistantes, et il
est bien
toléré.18-22
Son tolérance a été étudiée en Afrique et
s'est montrée comparable à la sulfadoxine-pyriméthamine
en terme de fréquence des évènements indésirables,
même si des inquiétudes persistent sur son effet sur les enfants
G6PD (glucose 6-phosphate déshydrogénase)-déficients
africains.21
Ceci pourrait être important pour l'Afghanistan et le Pakistan, des
études dans la population générale ayant montré
une prévalence élevée de la déficience en G6PD
dans certains groupes ethniques, et des variantes asiatiques de la
déficience peuvent conduire à des hémolyses importantes
en présence de certains
antipaludéens23,24
La chimiorésistance aux antifolates chez P falciparum est
limitée comparée à l'Asie du
Sud-est.25
La stratégie pour un paludisme à P falciparum confirmé
est récemment passée à la
sulfadoxine-pyriméthamine, combinée avec l'artésunate,
mais en dehors de structures formelles où un pourcentage
élevé de cas de paludisme est soigné, la
monothérapie par antifolate, avec la sulfadoxine-pyriméthamine,
constitue la norme; pendant la phase initiale de l'essai, presque tous les cas
de paludisme à P falciparum de la région ont été
traités soit avec de la chloroquine soit par une monothérapie
avec sulfadoxine-pyriméthamine. Si les antifolates sont efficaces
contre le paludisme à P vivax en Asie du Sud, cela ouvrirait une
série de possibilités pour une stratégie de traitement
commun pour les paludismes à P vivax et à P falciparum.
Notre objectif a été d'étudier l'efficacité
relative et l'innocuité du chlorproguanil-dapsone, de la
sulfadoxine-pyriméthamine et de la chloroquine dans une population sud
asiatique.
METHODES
Sites d'étude et recrutement des patients
Notre étude a été menée sur deux sites: le
Malaria Reference Center de Jalalabad, en Afghanistan, et le village de
réfugiés d'Adizai au Peshawar, au Pakistan. Cette zone de
conflits et d'instabilité politique récurrents compte plus d'un
million de réfugiés afghans, vivant toujours au
Pakistan.26
Les patients recrutés sur le site pakistanais étaient des
réfugiés afghans et ceux du site afghan étaient des
habitants afghans de Jalalabad City et des régions environnantes. Les
sites sont, tous deux, placés dans un contexte
épidémiologique similaire; le paludisme est saisonnier, avec un
pic de transmission de P vivax pendant l'été et de P falciparum
pendant
l'automne.14-16
L'essai était ouvert, avec une randomisation en trois groupes des
patients ayant eu une confirmation microscopique de P vivax:
chlorproguanil-dapsone, sulfadoxine-pyriméthamine, ou chloroquine. Tout
patient âgé de plus de trois ans était éligible et
évalué pour la présence de paludisme en consultation
externe sur le critère d'antécédent de maladies
fébriles. Les critères d'inclusion incluaient la confirmation
microscopique de P vivax, être âgé de 3 ans ou plus, un
consentement écrit ou verbal en présence de témoins (par
les parents dans le cas des mineurs), la disponibilité pour le suivi et
l'acceptation d'être soumis au test de déficience à la
G6PD à l'admission. Les critères d'exclusion comprenaient un
état général nécessitant une hospitalisation, des
preuves d'infections ou de maladies concomitantes susceptibles de masquer la
réponse aux traitements, une allergie connue à l'une des classes
de médicaments étudiés, une déficience connue
à la méthémoglobine réductase, traitement avec un
antipaludéen connu au cours des sept derniers jours ou avec un
médicament à l'essai au cours des 30 derniers jours, une
anémie sévère (hémoglobine < 7g/dl), une
infection mixte (P vivax et P falciparum) et une grossesse (confirmée
par des examens), la lactation, ou les deux.
A la réception du consentement écrit, les patients
étaient admis dans l'étude et affectés d'un numéro
consécutif de patient. Chaque numéro de patient était
préalablement affecté à un groupe de traitement par
randomisation par blocs de tailles
variable6-10
(STATA version 7; STATACorp, College Statioin, Tex) à Londres, en
Angleterre. Ces nombres étaient consignés dans des enveloppes
opaques, ouverts par l'équipe de recrutement à ce stade;
l'ouverture de l'enveloppe validait l'admission à l'essai et les
analyses en intention de traitement étaient menées sur la base
de cette affectation. Les rapports de randomisations à la chloroquine,
sulfadoxine-pyriméthamine, et chlorproguanil-dapsone étaient de
1:2:2. Ce rapport avait été choisi en connaissance des taux
d'échec locaux de la chloroquine (efficacité >95 % contre le
paludisme à P vivax), permettant des estimations
précises,27,28
et sur le principe que la différence de taux d'efficacité entre
les antifolates, s'il y en avait, était vraisemblablement plus faible
que celle entre la chloroquine et n'importe lequel des antifolates.
Procédures de traitement et de suivi
Les patients recevaient, selon le cas, de la chloroquine par doses
fractionnées (base 250 mg) sur 3 jours, du chlorproguanil-dapsone
(respectivement 2.0 et 2.5mg/kg par jour) à des intervalles de 24
heures pendant 3 jours, ou de la sulfadoxine-pyriméthamine
(respectivement 25mg/kg et 1.25mg/kg) en dose unique au premier jour suivi de
2 jours de comprimés placebo (qui ne sont pas exactement identiques aux
tablettes de sulfadoxine-pyriméthamine).
L'utilisation de la primaquine sur une durée de 5 jours pour une
thérapie radicale comme stratégie de traitement nationale avait
été abandonnée plusieurs années avant
l'étude du fait de la faible efficacité28; de ce fait (en
conformité avec la stratégie locale), aucun patient n'avait
reçu ce médicament pendant la période de suivi. Toutes
les doses étaient administrées sous contrôle et les
patients étaient mis en observation pendant 30 minutes après la
prise. Des vomissements dans cet intervalle étaient
considérés comme un évènement indésirable
et le patient recevait une nouvelle dose.
Les patients étaient évalués aux jours J 1, J 2, J 3,
J 7, J 14, J 21 et J 28 ou tout autre jour où ils se sentaient
indisposés par l'infection due à P vivax. Des frottis sanguins
et des gouttes épaisses étaient réalisés chaque
jour pendant le suivi de 28 jours pour évaluer la présence de
parasites Les lames étaient analysées par deux microscopistes
indépendants, en insu du traitement affecté au résultat
de l'autre. Les lames, à l'origine d'un désaccord étaient
analysées, en insu du groupe de traitement et des
précédents diagnostics, par un troisième microscopiste
d'un laboratoire indépendant. Les résultats étaient admis
selon une règle de << 2 sur 3 >>. Le taux d'hémoglobine
était mesuré chaque jour de suivi en utilisant un
hémoglobinomètre HemoCue (HemoCue AB, Ängelholm,
Suède). La bilirubine, la créatinine, et l'alanine
aminotransférase étaient mesurées à J 0, J 7, J 14
J 21 et J 28, utilisant un Reflotron Plus (Roche UK, Welwyn Garden City,
Angleterre) et un hémogramme complet par microscopie. Les femmes en
âge de procréer avaient un test de grossesse à J 0, J 14
et J 28. Au moment du recrutement, une déficience phénotypique
en G6PD était recherchée chez les patients, par la
méthode Sigma (Sigma-Aldrich Co, Gillingham, Angleterre). Les patients
G6PD-déficients subissaient une évaluation supplémentaire
de l'hémoglobine à J4, J 5 et J 6. Les évènements
indésirables étaient notés à chaque
évaluation et gradués selon une échelle standard
préétablie, basée sur la sévérité et
la fréquence des évènements.
Critères d'évaluation
Le critère d'évaluation principal était l'échec
parasitologique à J 14, évalué en insu du traitement
affecté. Le principal critère d'évaluation secondaire
était l'échec parasitologique et l'échec clinique au
28ème
jour.29
L'échec clinique était défini par la présence de
parasites et une température au moins égale à 37.5°C
à tout moment entre J3 et J28. Les autres critères
d'évaluation secondaires importants étaient le degré
d'anémie (hémoglobine <10g/dl) et la proportion de
gamétocytes. Les critères d'évaluation de la
tolérance étaient la fréquence des
évènements indésirables jusqu'au jour 14 et les
variations de l'hémoglobine chez les patients G6PD-déficients
comme preuves potentielles d'une hémolyse. L'efficacité sur 14
jours a été choisie comme critère d'évaluation
principal car la recrudescence due à un échec du
médicament et la rechute due aux hypnozoïtes ne pouvaient
être différenciées par des moyens moléculaires. Les
rechutes sont susceptibles de masquer une vraie recrudescence après les
2 premières semaines suivant le traitement.
Analyses statistiques
L'étude a été conçue pour détecter la
supériorité du chlorproguanil-dapsone sur la
sulfadoxine-pyriméthamine ou l'inverse, et la
supériorité, ou le contraire, de la chloroquine sur l'un ou
l'autre des deux folates. La taille de l'échantillon a
été calculée pour détecter une différence
de 85% par rapport au taux de guérison de 70% dans les deux groupes
antifolates et entre une efficacité de 99% dans le groupe chloroquine
et de 91% dans n'importe lequel des groupes antifolates (sur une rapport de
randomisation de 1:2:2) avec  = 0.05 et β = 0.80. Une taille
totale de 750 prenait en compte les pertes au suivi. Le plan d'analyse a
été validé par un comité de surveillance
indépendant, avant la complétion de la collecte de
données. Les données étaient doublement saisies et
comparées en utilisant Microsoft excel XP (Microsoft Corp, Redmond,
Washington) et analysées avec STATA version 7 (STATACorp). = 0.05 et β = 0.80. Une taille
totale de 750 prenait en compte les pertes au suivi. Le plan d'analyse a
été validé par un comité de surveillance
indépendant, avant la complétion de la collecte de
données. Les données étaient doublement saisies et
comparées en utilisant Microsoft excel XP (Microsoft Corp, Redmond,
Washington) et analysées avec STATA version 7 (STATACorp).
Les résultats étaient mesurés en pourcentage et un
modèle de régression logistique avait été
construit, avec des calculs de rapports de cote (RC) non corrigés et
ajustés pour des facteurs de bruits potentiels. L'investigation portait
sur les associations entre les résultats et les facteurs
prédéterminés incluant l'âge, le sexe, la
présence de fièvres, l'anémie, la parasitémie au
recrutement et le site d'étude. Les facteurs indépendamment
associés aux résultats sur un intervalle de confiance de 90%
étaient inclus dans le modèle multivariable final. Tous les
patients recrutés étaient classés en succès du
traitement, échec du traitement, perdus de vue, ou sorties de
l'étude. Les sorties étaient par la suite définies selon
leurs causes (évènement indésirable, violation du
protocole, ou retrait du consentement). Une analyse de tolérance
supplémentaire a été réalisée, classant
toutes les sorties et les perdus de vu dans les échecs.
|
|

|
|
Figure 1.. Distribution des patients
|
|
|
Validation éthique
La validation éthique a été délivrée par
le comité national de bioéthique du Pakistan Medical Research
Council, le Ministère de la Santé du gouvernement de transition
afghan, et le comité d'éthique du London School of Hygiene and
Tropical Medicine. L'UNHCR, l'Agence des Nations Unies pour les
Réfugiés, a également donné son aval. Un
comité de surveillance indépendant évaluait les
données de santé, les évènements
indésirables graves et définissait à l'avance les
règles d'arrêt. L'essai avait été préinscrit
sur une base de données d'accès libre
(http://www.clinictrials.gov).
RESULTATS
20 410 patients ont été évalués pour le
paludisme sur les deux sites (9705 au Pakistan et 10705 en Afghanistan), avec
2722 patients positifs pour P vivax. Chez ces patients, au total, 767 patients
(315 au Pakistan et 452 en Afghanistan) ont été recrutés
entre mars 2004 et juin 2006. Au total, 159 patients ont été
randomisés vers la chloroquine, 306 vers la
sulfadoxine-pyriméthamine et 302 vers le chlorproguanil-dapsone. Les
raisons principales de non-inclusion des patients infectés de P vivax
étaient le non-consentement, l'incapacité à se
présenter au suivi, ou une maladie concomitante. La distribution des
patients dans l'essai est illustrée par la
figure 1. Au total, 716
patients sur 767 (93.4%) ont complété le traitement et le suivi
jusqu'au 28ème jour (90.4% dans le groupe chlorproguanil-dapsone, 94.8%
dans le groupe sulfadoxine-pyriméthamine et 96.3% dans le groupe
chloroquine). Cinquante et un patients ont été soient perdus de
vue (n=31) soient exclus/retirés de l'essai (n=20). Neuf de ces
patients sont revenus sur leur consentement, 10 sont sortis à cause
d'évènements indésirables, et un pour une violation du
protocole. Les caractéristiques initiales étaient similaires
entre les groupes (TABLEAU
1).
|
|

|
|
Tableau 1.. Valeurs caractéristiques initiales par groupe de
traitement*
Abréviations: IC, intervalle de confiance; G6PD, glucose-6-phosphate
déhydrogenase; ElQ, écart interquartile.
*Données présentées sous forme Nb. (%) sauf
indication contraire.
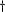 Anémie définie comme un niveau d'hémoglobine
< 10 g/dl. Anémie définie comme un niveau d'hémoglobine
< 10 g/dl.
|
|
|
Les résultats pour le critère d'évaluation principal
et les principaux critères d'évaluation secondaires sont
montrés à la table
2, avec le temps jusqu'à l'échec, relatif à
chaque médicament, dans la figure
2. A J14, le parasite avait été
éliminé chez tous les patients des 3 groupes. D'après le
critère principal d'efficacité, les trois médicaments
avaient donc une efficacité comparable et élevée.
Après 28 jours, le chlorproguanil-dapsone devenait moins efficace que
la sulfadoxine-pyriméthamine et la chloroquine, avec 27 patients sur
273 (9.9%) réfractaires au traitement. Les taux d'échec de la
chloroquine (2 sur 153 patients [1.3%]) et de la
sulfadoxine-pyriméthamine (5 sur 290 patients [1.7%]) étaient
similaires. Les RC non ajustés et ajustés pour l'échec
à J28 dans les 3 groupes sont montrés à la
table 3. Les taux
d'échec cliniques étaient comparables entre les groupes de
traitement jusqu'à J14 et J 28
(Tableau 2).
|
|

|
|
Tableau 2.. Proportion de patients en échec de traitement, par groupe de
traitement et par jour de suivi
Abréviations: IC, intervalle de confiance.
*L'échec clinique est défini comme la
présence de parasites et une température au moins égale
à 37.5°C à n'importe quel jour entre j3 et j14 ou
j28.29
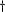 Données sur la température indisponibles pour 7
patients. Données sur la température indisponibles pour 7
patients.
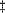 Données sur la température indisponibles pour 11
patients. Données sur la température indisponibles pour 11
patients.
|
|
|
|
|

|
|
Figure 2.. Courbe de Kaplan-Meier pour les échecs de traitement cumulés
sur la période de suivi de 28 jours
|
|
|
|
|

|
|
Tableau 3.. RC non ajustés et ajustés pour l'échec parasitologique
à j28; ajustement en fonction de l'âge et du site
d'étude.
Abréviations: IC, intervalle de confiance; RC, rapport des cotes
|
|
|
Les classes d'âge et le site d'étude ont été
indépendamment associés au résultat du traitement
à un niveau de confiance de 90% et ont été inclus dans la
régression logistique multivariable pour calculer les RC
ajustés. A l'inclusion, le sexe, l'anémie, la fièvre et
la parasitémie asexuée n'avaient pas été pris en
compte. Le chlorproguanil-dapsone était moins efficace que la
sulfadoxine-pyriméthamine (RCA 6.4; IC 95%, 2.4-17.0; P < 0.01) et
la chloroquine (RCA 8.4, IC 95%, 2.0-36.5, P=0.004).
Dans les deux cas, ceci est significatif, même avec un ajustement
strict pour 6 comparaisons (chloroquine vs sulfadoxine-pyriméthamine,
chloroquine vs chlorproguanil-dapsone, sulfadoxine-pyriméthamine vs
chlorproguanil-dapsone à J14 et J28). Pour un usage en santé
publique, la chloroquine et la sulfadoxine-pyriméthamine étaient
similaires en efficacité à 28 jours (RCA 1.3, IC 95%, 0.3-7.0,
P=0.73).
Il y a eu plus de perdus de vu dans le groupe chlorproguanil-dapsone que
dans les deux autres. A cause de ce biais potentiel, une analyse
complémentaire avait été entreprise, classant tous les
perdus de vu et les sorties dans les échecs. Ceci a abouti à un
taux d'échec à J28, de 5.3% pour la chloroquine, 7.4% pour la
sulfadoxine-pyriméthamine et 23.3% pour le chlorproguanil-dapsone (cas
le plus défavorable). Les rapports de cotes pour l'échec
parasitologique à J28 étaient de 3.2 (IC 95%, 1.9-5.4) pour une
comparaison chlorproguanil-dapsone vs sulfadoxine-pyriméthamine et de
4.4 (IC 95%, 2.0-9.5) pour chlorproguanil-dapsone vs chloroquine. La
sulfadoxine-pyriméthamine et la chloroquine demeuraient identiques (RC
1.4; IC 95%, 0.6-3.2).
Il n'a pas été possible de différencier la
recrudescence de la rechute, et l'identification d'une nouvelle infection est
d'utilité limitée avec le paludisme à P vivax. Dans une
analyse secondaire de sous-groupes, la différence entre le
chlorproguanil-dapsone et les autres groupes a été presque
entièrement due aux patients âgés de 3 à 10 ans,
dans le groupe chlorproguanil-dapsone de Jalalabad
(Table 4). Stratifié en
fonction du sexe, l'hémoglobine était significativement plus
faible au recrutement pour les patients de 3-10 ans de Jalalabad City que ceux
d'Adizai (hommes: moyenne, 11.6 vs 12.3 g/dl; par test t, P < 0.001; et
femmes: moyenne, 11.7 vs 12.2g/dl; par test t, P=0.005), ce qui pourrait
suggérer une différence d'état nutritionnel entre les
participants des deux sites.
|
|

|
|
Tableau 4.. Echecs de traitement au 28ème jour, stratifié selon le groupe
d'âge et le site de l'étude
|
|
|
L'élimination des parasites asexués du sang a
été atteinte plus vite dans le groupe chloroquine que dans les
deux autres groupes (figure 3)
avec une élimination pour 100% des patients à J2 pour la
chloroquine, et à J7 pour la sulfadoxine-pyriméthamine et le
chlorproguanil-dapsone. La chloroquine conduisait également à
une élimination plus rapide des gamétocytes, comparativement
à la sulfadoxine-pyriméthamine et le chlorproguanil-dapsone
(Figure 3). L'anémie a
varié avec le temps, selon le médicament étudié,
avec la chloroquine associée au taux le plus bas
(Table 5). Seuls 6 patients
G6PD-déficients ont été inclus dans l'essai (1 dans le
groupe chloroquine, 3 dans le groupe sulfadoxine-pyriméthamine et 2
dans le groupe chlorproguanil-dapsone), rendant difficile une comparaison
statistique robuste de la tolérance. Dans le groupe
chlorproguanil-dapsone, l'hémoglobine d'un patient avait diminué
de 10.7g/dl à 8.3g/dl en 24 heures, accompagnée d'une douleur
abdominale, de pâleur, et de migraine, et le patient a été
retiré de l'étude par précaution. L'autre patient
G6PD-déficient, traité au chlorproguanil-dapsone n'a pas eu de
diminution de l'hémoglobine. La diminution maximale de
l'hémoglobine, observée, après traitement, chez les
autres patients G6PD-déficients a été de 1.1g/dl (1
patient du groupe chloroquine) et 2.0g/dl, 0.5g/dl et 1.4g/dl (3 patients du
groupe sulfadoxine-pyriméthamine).
|
|

|
|
Figure 3.. Proportion de patients portant des parasites asexués et des
gamétocytes au jour de suivi en fonction du groupe de traitement.
|
|
|
|
|

|
|
Tableau 5.. Pourcentage de patients anémiés (Hémoglobine <10
g/dl) par jour de suivi*
Abréviations: IC, intervalle de confiance.
*Données présentées sous forme % (IC 95%)
[écart par rapports aux valeurs initiales]
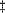 2 2 = 6.4, P = .04. 2 2 = 6.4, P = .04.
ix2 = 174, p<.001
 X2 = 6.7, P = .04 X2 = 6.7, P = .04
|
|
|
Aucun évènement indésirable grave n'a
été observé pendant l'essai et aucun patient n'a
nécessité d'hospitalisation. Tous les médicaments
étudiés ont été bien tolérés,
malgré des différences visibles dans la fréquence des
évènements indésirables entre les groupes de traitement
(Table 6). La chloroquine a
été associée à la fréquence la plus basse
de tout évènement indésirable. La fréquence des
nausées et vomissement a été plus élevée
dans le groupe chloroquine, mais n'a pas été associée
à l'échec clinique dans le groupe de 3 à 10 ans.
|
|

|
|
Tableau 6.. Profil de survenue des évènements indésirables en
fonction du groupe de traitement et du jour de suivi.
*Indique une différence significative au test
x2 entre les groupes de traitement (P<.05).
|
|
|
COMMENTAIRES
 |  |
Pendant des années, il a été supposé, sur la
base des premières études, soutenues par des données plus
récentes provenant de l'Asie du Sud-est et de l'Indonésie, que P
vivax était chimiorésistant aux antifolates. Les données
provenant de notre étude montrent que, dans cette partie de l'Asie du
Sud, à l'époque actuelle, le paludisme à P vivax est
sensible aux antifolates et à la chloroquine durant la première
période de suivi de 14 jours. Parce que P vivax ne se cantonne pas dans
les micro-vaisseaux, les études de médicaments contre le
paludisme à P vivax fournissent une mesure directe de l'activité
antipaludéenne.
On peut conclure que la chloroquine, la sulfadoxine-pyriméthamine et
le chlorproguanil-dapsone sont tous efficaces contre la phase aigue du
paludisme à P vivax, et la classe des antifolates, par
conséquent, peut avoir un potentiel d'utilisation beaucoup plus grand
qu'initialement imaginé dans les zones d'infection mixte. Bien que la
chloroquine doit rester le médicament de choix dans les cas
prouvés de paludisme à P vivax, cette étude
soulève la possibilité d'une stratégie de traitement
commune au paludisme à P falciparum et à P vivax, faisant appel
aux antifolates, lorsque une différenciation fiable des espèces
n'est pas possible ou en cas d'infection mixte. Dans un schéma de
monothérapie par la sulfadoxine-pyriméthamine pour des cas
présumés de paludisme à P falciparum (souvent
pratiqué par les soignants du secteur privé), le traitement
agira sur le paludisme à P vivax en en cas de mauvais diagnostic ou
d'infection mixte. Avec le retard de la thérapie combinée, la
combinaison sulfadoxine-pyriméthamine et artésunate est
maintenant le traitement recommandé pour le paludisme à P
falciparum en Afghanistan, et l'usage des antifolates augmente au Pakistan.
Les résultats de notre essai démontrent qu'en cas de mauvais
diagnostic, P vivax serait correctement traité en adoptant ce
schéma. Du fait des activités anti-P vivax des artemisinins, les
thérapies combinées à base d'artemisinin qui incluent un
antifolate sont à même d'être plus efficaces contre P vivax
qu'un antifolate utilisé
seul.23,30
Malgré un taux de guérison supérieur à 85% pour
tous les médicaments étudiés à l'examen
parasitologique durant la période de suivi de 28 jours, la
sulfadoxine-pyriméthamine était aussi efficace que la
chloroquine et légèrement plus efficace que le
chlorproguanil-dapsone. Les perdus de vu étaient plus nombreux dans le
groupe chlorproguanil-dapsone, introduisant un biais probable. Mais même
dans l'interprétation la plus pessimiste, considérant les perdus
de vu et les sorties d'étude comme des échecs, les
différences relatives entre les groupes demeuraient inchangées.
Dans la pratique, la plupart des perdus de vu l'ont été pour des
raisons considérées aléatoires (ex: déplacement),
et les sorties d'étude ont été secondaires à des
évènements indésirables relativement mineurs; de ce fait,
une interprétation de ces résultats comme manquants serait
vraisemblablement une approche beaucoup plus réaliste.
Les demi-vies des 2 composants de la sulfadoxine-pyriméthamine sont
respectivement de 116 et 81 heures contre 12 à 20 heures et 20 à
30 heures pour le chlorproguanil-dapsone. Il est possible que le
chlorproguanil-dapsone soit intrinsèquement moins actif que la
sulfadoxine-pyriméthamine, mais il parait probable que les actions
prophylactiques connues de la sulfadoxine-pyriméthamine et de la
chloroquine jouent un rôle. Une rechute peut (et c'est souvent le cas)
se produire dans le premier mois suivant l'infection, cependant, dans cette
région, le premier épisode de paludisme après un
traitement à la chloroquine se produit généralement de 45
à 90 après le traitement. Le profil temporel de la rechute est
compliqué par le réservoir d'hypnozoïtes provenant des
infections antérieures au recrutement à l'étude. Les
hypnozoïtes peuvent provoquer des épisodes aigues pendants des
années après l'infection initiale; de ce fait, l'échec du
traitement chez certains patients peut être dû à des
infections antérieures et non pas à l'épisode aigu en
cours. Les marqueurs moléculaires disponibles ne différencient
pas de manière fiable entre la rechute de la recrudescence, rendant les
conclusions fermes impossibles.
L'essai n'était pas statistiquement adapté pour l'analyse de
sous-groupes, mais la différence entre l'efficacité du
chlorproguanil-dapsone chez des enfants des sites afghans et pakistanais est
frappante. Plusieurs possibilités doivent être envisagées.
Une erreur systématique de dosage dans le groupe des 3-10 ans avait
été envisagée mais les dossiers n'ont
révélé aucune différence des doses
consignées entre les deux sites d'étude et les patients
étaient surveillés pendant 30 minutes en cas de vomissements.
Les médicaments étaient administrés de manière
identique sur les deux sites, avec une petite quantité de nourriture et
de l'eau. A Jalalabad, les doses étaient broyées et
administrées avec de l'eau; tandis qu'en Adizai, elles étaient
administrées sous forme de comprimés entiers (ou des fractions).
Il semble peu probable que le broyage puisse amener à une
réduction de la biodisponibilité (plutôt l'inverse), mais
il est possible que des particules de comprimés aient été
perdues pendant le broyage ou soient restées au fond des béchers
de dilution. Toutefois, il est peu vraisemblable que cela ait affecté
uniquement le chlorproguanil-dapsone.
Les comptes-rendus quotidiens sur les troubles gastro-intestinaux n'ont
révélé aucune différence entre les succès
et les échecs dans ce groupe d'âge, ce qui exclut le vomissement
des facteurs intervenants dans le dosage. De façon anecdotique, les
conditions socio-économiques à Jalalabad (et en Afghanistan en
général) sont bien pires que dans le camp de
réfugiés de l'autre côté de la frontière, au
Pakistan. Les facteurs nutritionnels (également liés aux
conditions socio-économiques) peuvent affecter la
pharmacocinétique, l'immunité et la susceptibilité
à une maladie. La tolérance du chlorproguanil-dapsone chez des
patients G6PD-déficients ne peut être évaluée
à partir de ces données car moins de patients ayant cette
déficience se sont présentés à l'étude que
ce qui était anticipé en fonction de la population
générale (prévalence de 3%-15% chez les
pachtouns).23,24
Ceci soulève la possibilité d'un effet protecteur de la G6PD via
à vis du paludisme à P vivax; effet déjà
décrit pour P falciparum en
Afrique,32
et qui aurait des implications sur les médicaments (en particulier la
primaquine et la tafénoquine, des médicaments antihypnozoites)
contre-indiqués pour les patients G6PD-déficients. La G6PD a
été mesurée par raison de sécurité
concernant l'interaction entre la déficience en G6PD et le
chlorproguanil-dapsone. L'effet du dapsone sur des patients G6PD a
été décrit. La variante africaine de G6PD est
considérée comme étant généralement moins
susceptible de conduire à une hémolyse grave que la variante
asiatique ou méditerranéenne. Des données montrant qu'un
patient G6PD-déficient traité avec du chlorproguanil-dapsone
avait eu une diminution de l'hémoglobine de plus de 2g/dl en 24 heures,
nécessitant un retrait de l'essai, ne suffit pas à conclure (une
diminution en hémoglobine s'était également produite pour
la chloroquine et la sulfadoxine-pyriméthamine), mais est compatible
avec l'hypothèse d'une interaction entre la variante asiatique de la
déficience et le chlorproguanil-dapsone. D'autres données de
santé chez des personnes G6PD-déficients du sud de l'Asie
pourraient être nécessaires.
Cet essai suggère que la chimiorésistance de P vivax à
l'antifolate est régionale, et implique probablement des allèles
des résistances aux médicaments spécifiques (comme le
paludisme à P falciparum) plutôt qu'une résistance
intrinsèque à cette classe de médicaments. La
résistance à la sulfadoxine-pyriméthamine est
associée à des mutations spécifiques successives sur le
gène de la dyhydrofolate réductase de P vivax
(Pvdhfr).13
Les échecs de la sulfadoxine-pyriméthamine dans les cas de
paludismes à P vivax sulfadoxine-pyriméthamine résistants
avaient été associés dans une étude in vivo
à une absence de clairance parasitaire jusqu'à sept jours
après le
traitement,9
mais tous les patients de notre étude avaient pu éliminer les
parasites au septième jour. Une étude, en contradiction avec une
autre,33
avait montré que le chlorproguanil-dapsone permettait la
sélection des triples mutations du gène dhfr pour le Plasmodium
falciparum
africain.34
Il n'y a actuellement aucune donnée sur l'interaction de
l'activité du chlorproguanil-dapsone et des mutations Pvdhfr. Les
composants sulfonés des médicaments antifolates agissent sur la
dihydroptéroate synthase dont les mutations en présence de
mutations Pvdhfr multiples et l'association aux échecs de traitements
ont été
démontrées.12
La résistance à la proguanil a été
rapportée pour le paludisme à P
vivax,35
mais il existe des données discordantes sur l'action du chlorproguanil
sur P vivax. Il paraît probable que si la large utilisation de la
sulfadoxine-pyriméthamine en monothérapie est maintenue, les
mutations pvdhfr pourraient rendre le paludisme à P vivax
résistant aux médicaments antifolates comme elles l'ont fait
avec le paludisme à P
falciparum.36
Notre essai démontre qu'en Asie du Sud, où la
résistance aux antifolates est limitée chez P falciparum, et
d'après l'étude, chez P vivax, les antifolates pourraient
être utilisés dans un schéma de traitement commun dans les
zones d'infections mixtes, idéalement avec un artemisinin.
Informations sur les auteurs
Correspondance: Toby Leslie, MSc, London School of Hygiene and Tropical
Medicine, Keppel Street, London WC1E 7HT, England
(toby.leslie{at}lshtm.ac.uk).
Contributions de l'auteur: Mr Leslie a eu un accès complet
à toutes les données de l'étude et accepte la
responsabilité de l'intégrité et de l'exactitude de
l'analyse des données.
Conception et schéma de l'étude: Leslie, Whitty,
Rowland.
Recueil des données: Leslie, Mayan, Hasan, Safi,
Whitty.
Analyse et interprétation des données: Leslie,
Klinkenberg, Whitty, Rowland.
Recueil du manuscript: Leslie, Mayan, Hasan, Safi, Whitty,
Rowland.
Revue critique du manuscript: Leslie, Klinkenberg, Whitty,
Rowland.
Analyse statistique: Leslie, Whitty.
Obtention du financement: Leslie, Whitty, Rowland.
Aide administrative, technique ou matérielle: Leslie,
Mayan, Hasan, Safi, Klinkenberg.
Supervision de l'étude: Leslie, Mayan, Hasan, Safi, Whitty,
Rowland.
Liens financiers: Mr Leslie a déclare avoir participé
à un meeting sponsorisé d'un jour organisé par
GlaxoSmithKline et avoir été reçu des honoraires. Les Drs
Whitty et Rowland ont déclaré être soutenu par Gates
Malaria Partnership avec un financement de la Bill &Melinda Gates
Foundation. Aucun autre auteur n'a rapporté de liens financiers.
Financement/Soutien: L'étude était finance par
GlaxoSmithKline pour un essai indépendant initié par un
investigateur. Les Drs Whitty et Rowland ont bénéficié du
soutien du Gates Malaria Partnership. HealthNet TPO Malaria and Leishmaniasis
Control Programme est finance par la Commission Européenne, le Global
Fund for AIDS, TB, and Malaria, le Haut-Commissariat des Nations Unies pour
les réfugiés et le programme spécial de l'Organisation
Mondiale de la Santé pour la recherche sur les maladies tropicales.
Aucun de ces donneurs n'a contribué directement à
l'étude.
Rôle des sponsors: GlaxoSmithKline n'a joué aucun
rôle dans le schéma et la conduite de l'étude, dans le
recueil, la gestion, l'analyse et l'interpréation des données ni
dans la préparation, la revue ou l'approbation du manuscrit. Avant la
mise en place, GlaxoSmithKline et le sponsor (London School of Hygiene and
Tropical Medicine) ont fait des commentaires mineurs sur le protocole.
HealthNet TPO a mis en place le projet sir me terrain, avec un support
technique de la London School of Hygiene and Tropical Medicine. L'analyse des
données a été effectuée par les Drs Whitty et
Rowland, et Mr Leslie selon un plan d'analyse pré-défini
approuvé par tous les auteurs et le comité de surveillance des
données et de la tolérance.
Note: Aucun de ces donneurs n'est nécessairement d'accord
avec les vues exprimées dans cet article, qui sont ceux des
auteurs.
Remerciements: Nous remercions toutes les personnes qui ont
participle à l'étude au Pakistan et en Afghanistan. Nous
remercions les institutions suivantes et les personnes suivantes pour leur
aide: Ministère de la Santé Publique de l'Afghanistan; le
Pakistan Medical Research Council; le Haut-Commissariat des Nations Unies pour
les réfugiés; Malaria Reference Center, Jalalabad, Afghanistan;
Union Aid for Afghan Refugees, Peshawar, Pakistan; Health-Net TPO Head Office,
Amsterdam, Pays-Bas; M. Nader Nadeem, MD, Sayed Rahim, MD, Nasir Mohammed,
MSc, Naeem Durrani, MSc, Majeed Sidiqi, MPH (HealthNet TPO) et les techniciens
et les travailleurs sociaux qui ont participé à l'étude.
Nous remercions le comité de surveillance des données et de la
tolerance pour ses conseils: A.D. Bryceson, FRCP (chair), Tasleen Akhtar,
FRCP, Neal Alexander, PhD, and Brian Greenwood, FRCP, et G. Targett, DSc.
Aucune de ces personnes remerciées ici n'a reçu de compensation
financière pour sa participation.
Affiliations des auteurs: HealthNet TPO Malaria and Leishmaniasis
Control Programme, Peshawar, Northwest Frontier Province, Pakistan; Department
of Infectious and Tropical Diseases, London School of Hygiene and Tropical
Medicine, London, England.
BIBLIOGRAPHIE
 |  |
1. Guerra CA, Snow RW, Hay SI. Mapping the global extent of malaria in
2005. Trends Parasitol.2006; 22:353
-358.
PUBMED
2. Mendis K, Sina BJ, Marchesini P, Carter R. The neglected burden of
Plasmodium vivax malaria. Am J Trop Med Hyg.2001; 64(suppl):97
-106.
FREE FULL TEXT
3. Guerra CA, Snow RW, Hay SI. Defining the global spatial limits of
malaria transmission in 2005. Adv Parasitol.2006; 62:157
-179.
PUBMED
4. Baird JK. Chloroquine resistance in vivax malaria.
Antimicrob Agents Chemother.2004; 48:4075
-4083.
FREE FULL TEXT
5. World Health Organization. The Use of Rapid Malaria Diagnostic
Tests, Second Edition.
http://www.wpro.who.int/sites/rdt/documents/PUB_9290612045.htm.
Accessed November 25, 2006.6. Bell D, Wongsrichanalai C, Barnwell JW. Ensuring quality and access
for malaria diagnosis: how can it be achieved? Nat Rev
Microbiol.2006; 4(suppl):S7
-S20.
PUBMED
7. Connolly MA, Gayer M, Ryan MJ, Salama P, Spiegel P, Heymann DL.
Communicable diseases in complex emergencies: impact and challenges.
Lancet. 2004; 364:1974
-1983.
PUBMED
8. Young MD, Burgess RW. Pyrimethamine resistance in Plasmodium
vivax malaria. Bull World Health Organ.1959; 20:27
-36.
PUBMED
9. Pukrittayakamee S, Chantra A, Vanijanonta S, et al. Therapeutic
responses to different antimalarial drugs in vivax malaria.
Antimicrob Agents Chemother.2000; 44:1680
-1685.
FREE FULL TEXT
10. Wilairatana P, Silachamroon U, Krudsood S, et al. Efficacy of
primaquine regimens for primaquine-resistant Plasmodium vivax malaria
in Thailand. Am J Trop Med Hyg.1999; 61:973
-977.
ABSTRACT
11. Imwong M, Pukrittayakamee S, Looareesuwan S, et al. Association of
genetic mutations on Plasmodium vivax dhfr with resistance to
sulfadoxine-pyrimethamine: geographical and clinical correlates.
Antimicrob Agents Chemother.2001; 45:3122
-3127.
FREE FULL TEXT
12. Imwong M, Pukrittayakamee S, Cheng Q, et al. Limited polymorphism
in the dihydropteroate synthetase gene (dhps) of Plasmodium
vivax isolates from Thailand. Antimicrob Agents
Chemother. 2005;49:4393
-4395.
FREE FULL TEXT
13. White NJ. Antimalarial drug resistance. J Clin
Invest. 2004;113:1084
-1092.
PUBMED
14. Rowland M, Rab MA, Freeman T, Durrani N, Rehman N. Afghan refugees
and the temporal and spatial distribution of malaria in Pakistan.
Soc Sci Med.2002; 55:2061
-2072.
PUBMED
15. Brooker S, Leslie T, Kolaczinski K, et al. Spatial epidemiology of
Plasmodium vivax, Afghanistan. Emerg Infect
Dis. 2006;12:1600
-1602.
PUBMED
16. Kolaczinski J, Graham K, Fahim A, Brooker S, Rowland M. Malaria
control in Afghanistan: progress and challenges.
Lancet. 2005;365:1506
-1512.
PUBMED
17. Lang T, Greenwood B. The development of Lap-dap, an affordable new
treatment for malaria. Lancet Infect Dis.2003; 3:162
-168.
PUBMED
18. Amukoye E, Winstanley PA, Watkins WM, et al.
Chlorproguanil-dapsone: effective treatment for uncomplicated falciparum
malaria. Antimicrob Agents Chemother.1997; 41:2261
-2264.
FREE FULL TEXT
19. Mutabingwa TK, Maxwell CA, Sia IG, et al. A trial of
proguanil-dapsone in comparison with sulfadoxine-pyrimethamine for the
clearance of Plasmodium falciparum infections in Tanzania.
Trans R Soc Trop Med Hyg.2001; 95:433
-438.
PUBMED
20. Sulo J, Chimpeni P, Hatcher J, et al. Chlorproguanil-dapsone versus
sulfadoxine-pyrimethamine for sequential episodes of uncomplicated falciparum
malaria in Kenya and Malawi: a randomised clinical trial.
Lancet. 2002;360:1136
-1143.
PUBMED
21. Alloueche A, Bailey W, Barton S, et al. Comparison of
chlorproguanil-dapsone with sulfadoxine-pyrimethamine for the treatment of
uncomplicated falciparum malaria in young African children: double-blind
randomised controlled trial. Lancet.2004; 363:1843
-1848.
PUBMED
22. Mutabingwa T, Nzila A, Mberu E, et al. Chlorproguanil-dapsone for
treatment of drug-resistant falciparum malaria in Tanzania.
Lancet. 2001;358:1218
-1223.
PUBMED
23. Bouma MJ, Goris M, Akhtar N, Khan N, Kita E. Prevalence and
clinical presentation of glucose-6-phosphate dehydrogenase deficiency in
Pakistani Pathan and refugee communities in Pakistan: implications for the use
of primaquine in regional malaria control programs. Trans R Soc
Trop Med Hyg. 1995; 89:62
-64.
PUBMED
24. Ali N, Anwar M, Ayyub M, Bhatti FM, Nadeem M, Nadeem A. Frequency
of glucose-6-phosphate dehydrogenase deficiency in some ethnic groups of
Pakistan. J Coll Physicians Surg Pak.2005; 15:137
-141.
PUBMED
25. Durrani N, Leslie T, Rahim S, Graham K, Ahmad F, Rowland M.
Efficacy of combination therapy with artesunate & amodiaquine compared to
monotherapy with chloroquine, amodiaquine or sulfadoxine-pyrimethamine for
treatment of uncomplicated Plasmodium falciparum in Afghanistan.
Trop Med Int Health.2005; 10:521
-529.
PUBMED
26. United Nations High Commissioner for Refugees. Top 5 refugee
hosting countries, beginning 2006. UN-HCR Country Information.
http://www.unhcr.org/country/pak.html.
Accessed December 4, 2006.27. Leslie T, Rab MA, Ahmadzai H, et al. Compliance with 14 day
primaquine therapy for radical cure of vivax malaria: a randomised placebo
controlled trial comparing supervised and unsupervised treatment.
Trans R Soc Trop Med Hyg.2004; 98:168
-173.
PUBMED
28. Rowland M, Durrani N. Randomised controlled trials of 5- and
14-days primaquine therapy against relapses of vivax malaria in an afghan
refugee settlement in Pakistan. Trans R Soc Trop Med
Hyg. 1999;93:641
-643.
PUBMED
29. Figueiredo MS, Pinto BO, Zago MA. Dapsone-induced haemolytic
anaemia and agranulocytosis in a patient with normal
glucose-6-phosphate-dehydrogenase activity. Acta
Haematol. 1989;82:144
-145.
PUBMED
30. Kolaczinski K, Durrani N, Rahim S, Rowland M. Efficacy of
sulphadoxine-pyrimethamine plus artesunate for the treatment of vivax malaria:
addressing concerns in areas of falciparum and vivax malaria. Trans
R Soc Trop Med Hyg. In press.31. Baird JK, Rieckmann KH. Can primaquine therapy for vivax malaria be
improved? Trends Parasitol.2003; 19:115
-120.
PUBMED
32. Ruwende C, Khoo SC, Snow RW, et al. Natural selection of hemi- and
heterozygotes for G6PD deficiency in Africa by resistance to severe malaria.
Nature. 1995;376:246
-249.
PUBMED
33. Curtis J, Maxwell CA, Msuya FH, Mkongewa S, Alloueche A, Warhurst
DC. Mutations in dhfr in Plasmodium falciparum infections selected by
chlorproguanil-dapsone treatment. J Infect Dis.2002; 186:1861
-1864.
FREE FULL TEXT
34. Nzila AM, Nduati E, Mberu EK, et al. Molecular evidence of greater
selective pressure for drug resistance exerted by the long-acting antifolate
Pyrimethamine/Sulfadoxine compared with the shorter-acting
chlorproguanil/dapsone on Kenyan Plasmodium falciparum. J Infect
Dis. 2000;181:2023
-2028.
35. World Health Organization. Guidelines for treatment of malaria.
WHO/HTM/MAL/2006.1108.
http://www.who.int/malaria/docs/TreatmentGuidelines2006.pdf.
Accessibility verified April 23, 2007.36. Tjitra E, Baker J, Suprianto S, Cheng Q, Anstey NM. Therapeutic
efficacies of artesunate-sulfadoxine-pyrimethamine and
chloroquine-sulfadoxine-pyrimethamine in vivax malaria pilot studies:
relationship to Plasmodium vivax dhfr mutations.
Antimicrob Agents Chemother.2002; 46:3947
-3953.
FREE FULL TEXT
|