 |
 |

PAGES DU PRATICIEN
Traitement du paludisme aux États-UnisUne revue systématique
Kevin S. Griffith, MD, MPH;
Linda S. Lewis, DVM, MPVM;
Sonja Mali, MPH;
Monica E. Parise, MD
RÉSUMÉ
 |  |
Contexte De nombreux cliniciens et personnels de laboratoire
américains connaissent mal le diagnostic et le traitement du
paludisme.
Objectifs Examiner la base de données relative à la
prise en charge du paludisme non compliqué et grave, et fournir aux
cliniciens des recommandations pratiques pour son diagnostic et son traitement
aux États-Unis.
Acquisition des données Recherche systématique dans la
base de données MEDLINE, de 1966 à 2006, à l'aide du
terme de recherche malaria (avec les qualificatifs congénital,
diagnostic, pharmacothérapie, épidémiologie, et
traitement). Des références complémentaires ont
été obtenues par une recherche dans les bibliographies des
articles pertinents et par une analyse d'articles proposés par des
experts du traitement du paludisme en Amérique du Nord.
Synthèse des données Les principales mesures visant
à réduire la morbidité et la mortalité du
paludisme aux États-Unis sont les suivantes: interroger les patients
sur leurs antécédents de voyage, considérer le paludisme
dans le diagnostic différentiel de la fièvre en se basant sur
les antécédents de voyage, établir un diagnostic rapide
et précis, et instaurer un traitement. La chloroquine reste le
traitement de référence pour le Plasmodium falciparum
contracté dans les régions exemptes de souches
chloroquino-résistantes. Dans les zones de
chloroquino-résistance, une association d'atovaquone et de proguanil,
ou de quinine plus tétracycline ou doxycycline ou clindamycine,
constituent les meilleures options thérapeutiques. La chloroquine reste
le traitement de référence pour toutes les autres espèces
plasmodiales, à l'exception de P. vivax contracté en
Indonésie ou en Papouasie-Nouvelle-Guinée, pour laquelle
l'association atovaquone-proguanil est le meilleur traitement, avec la
méfloquine ou la quinine plus tétracycline ou doxycycline en
alternatives. La quinidine est actuellement le traitement recommandé
pour le paludisme grave aux Etats-Unis, les artémisinines n'y
étant pas encore disponibles. Le paludisme grave est
diagnostiqué lorsqu'un patient avec une parasitémie
asexuée, sans aucune autre cause confirmée des symptômes,
présente 1 critère clinique ou biologique spécifique ou
plus. La seule mesure adjuvante recommandée dans le paludisme grave est
l'exsanguinotransfusion.
Conclusions Le paludisme reste une difficulté diagnostique et
thérapeutique pour les cliniciens américains, alors qu'un nombre
croissant de déplacements s'effectue à destination et en
provenance de zones impaludées. Il existe une base de données
solide sur laquelle les cliniciens peuvent s'appuyer pour initier rapidement
un traitement adapté et minimiser le poids considérable de la
mortalité et de la morbidité induit par cette maladie.
JAMA.
2007;297:2264-2277
MMême si le paludisme endémique a été
éliminé aux États-Unis, il reste l'une des
premières maladies infectieuses dans le monde. Ainsi, chaque
année aux États-Unis, 1 200 cas de paludisme sont
rapportés en moyenne, presque tous importés, entraînant
jusqu'à 13 décès par
an.1 La
mauvaise connaissance du paludisme et de ses profils de
chimiorésistance par les cliniciens et les personnels de laboratoire
américains contribue à des retards de diagnostic et de
traitement, parfois associés à des issues
fatales.2
Afin de traiter ce problème, nous apportons aux cliniciens des
recommandations pratiques pour le diagnostic et le traitement du paludisme aux
États-Unis, basées sur les données publiées,
l'expérience du CDC (Centers for Disease Control and Prevention) dans
l'assistance aux cliniciens américains, et les traitement et techniques
diagnostiques disponibles utilisés dans ce pays.
MÉTHODES
Nous avons effectué une recherche systématique dans MEDLINE,
de 1966 à 2006, en utilisant le terme de recherche malaria (avec les
qualificatifs congénital, diagnostic, pharmacothérapie,
épidémiologie, et traitement). Cette recherche, menée le
1er août 2006, a produit 5 588 articles potentiellement pertinents. Nous
avons revu les titres et/ou résumés de tous les articles pour
déterminer leur pertinence au regard de cet article; nous avons
effectué une recherche manuelle dans les bibliographies des articles
pertinents, et revu les articles suggérés par des experts dans
le traitement du paludisme en Amérique du Nord. Les recommandations
sont basées sur des études contrôlées
randomisées, des études d'observation, et des avis
d'experts.
CONSIDÉRATIONS BIOLOGIQUES ET ÉPIDÉMIOLOGIQUES
Dans le cycle de vie du Plasmodium
(Figure 1), les stades
érythrocytaires asexués (anneau, trophozoïte, schizonte)
sont responsables des symptômes du paludisme, et constituent par
conséquent la principale cible de la chimiothérapie. Les stades
sanguins sexués (gamétocytes) ne causent pas de pathologie
connue et ne sont donc pas une cible fondamentale des traitements. Les formes
dormantes au stade hépatique (hypnozoïte) de Plasmodium vivax et
de Plasmodium ovale peuvent se réactiver des semaines ou des mois
après l'infection initiale et provoquer des rechutes.
|
|

|
|
Figure 1.. Cycle de développement du plasmodium
|
|
|
Parmi les 4 espèces de Plasmodium infectant l'homme, Plasmodium
falciparum est la seule susceptible d'évoluer rapidement vers la
maladie grave ou le décès. Elle prédomine en Afrique
subsaharienne, à Hispaniola et en Papouasie-Nouvelle-Guinée.
Parmi les autres espèces, P. vivax est la plus commune et
prédomine dans le sud de l'Asie, en Europe de l'Est et en Asie
septentrionale, ainsi qu'en Amérique Centrale et dans la plus grande
partie de l'Amérique du
Sud.4
Plasmodium ovale sévit principalement en Afrique occidentale et se
rencontre occasionnellement en Asie du Sud-Est et en
Papouasie-Nouvelle-Guinée. La souche Plasmodium malariae est peu
fréquente et inégalement répartie dans le monde.
Plasmodium falciparum représente un peu plus de 50 % et P. vivax
environ 25 % des cas rapportés aux
États-Unis.1,2
Les souches chloroquinorésistantes de P. falciparum sévissent
dans toutes les zones endémiques, à l'exception de
l'Amérique centrale à l'ouest du canal de Panama, au Mexique,
à Hispaniola et dans certaines parties de la Chine, ainsi qu'au
Moyen-Orient; les souches multirésistantes se rencontrent quant
à elles dans le Sud-Est asiatique, en Amérique du Sud et en
Afrique subsaharienne. En raison de la résistance croissante de P.
falciparum à l'association sulfadoxine plus pyriméthamine, le
CDC ne recommande plus son utilisation dans le traitement du paludisme aux
États-Unis ou en traitement de réserve pour les voyageurs
américains. Une forte prévalence de P vivax
chloroquinorésistant a été observée en
Papouasie-Nouvelle-Guinée et en Indonésie. Baird et Hoffman ont
publié une excellente revue sur l'espèce P. vivax
chloroquinorésistante (avec une description détaillée de
sa distribution géographique).5 Des taux atteignant 25 % sont
rapportés dans quelques régions de Birmanie,6 de
Malaisie,7 du
Vietnam,8 d'Inde,9 et de
Turquie10,11.
| Encadré. Manifestations du paludisme
grave*
Prostration
Troubles de la conscience/coma
Détresse respiratoire (acidose respiratoire)
Crises convulsives répétées
Collapsus circulatoire
 dème pulmonaire dème pulmonaire
Syndrome de détresse respiratoire aiguë
Saignement anormal
Ictère
Anémie sévère
Insuffisance rénale aiguë
Coagulation intravasculaire disséminée
Acidose
Hémoglobinurie
Parasitémie > 5 %
* Sources: WHO Management of Severe Malaria (2000)21 et WHO
Guidelines for the Treatment of Malaria
(2006).22
|
|
RECONNAISSANCE ET DIAGNOSTIC
Considérer le paludisme en se basant sur les
antécédents de voyage constitue la clé du diagnostic.
Tout patient ayant séjourné dans une zone endémique dans
l'année précédant l'apparition des symptômes de
paludisme doit être évalué au regard de la maladie. La
période d'incubation varie classiquement de 9 à 18 jours pour P.
falciparum, P. vivax et P. ovale12; elle est plus longue (18-40 jours) pour P.
malariae et peut en revanche n'être que de 7 jours pour P. falciparum.13
Cependant, les symptômes peuvent survenir des semaines, voire des mois,
après l'exposition, à la suite d'une prophylaxie ou d'un
traitement inadaptés, de la réponse immunitaire ou de rechutes.
Certaines souches tempérées de P. vivax, notamment d'origine
nord-indienne ou nord-coréenne, peuvent produire un accès
primaire tardif, survenant 12 à 18 mois après une piqûre
de moustique infecté.14 Sur les cas rapportés aux
États-Unis entre 1995 et 2004, 98 % (n = 3 626) des patients avec
paludisme à P. falciparum ont présenté leurs premiers
symptômes dans les 3 mois suivant leur arrivée aux
États-Unis, et 57 % (n = 1 743) et 96 % (n = 2 906) de ceux avec
paludisme non falciparum ont connu une apparition des symptômes dans les
3 et 12 premiers mois respectivement. Dans cette même période, 85
% des patients avec paludisme à P falciparum importé
contractaient leur infection en Afrique.
L'absence d'antécédent de voyage n'exclut pas le paludisme.
Les patients peuvent rapporter une histoire imprécise ou avoir
été infectés aux Etats-Unis, par le biais d'autres
mécanismes rares tels qu'une transfusion, une transmission
congénitale, ou une transmission locale par
moustique.1
La présentation initiale du paludisme est non spécifique et
similaire à celle de nombreuses autres maladies fébriles. La
fièvre est le symptôme le plus communément
rapporté, dans 78 % à 100 % des cas
cliniques,2,15-18
mais la périodicité de la fièvre est souvent non
observée.15,19,20
Les patients peuvent présenter un large spectre d'autres
symptômes, tels que frissons, céphalées, malaises,
nausées, vomissements, diarrhées, douleurs abdominales,
myalgies, douleurs lombaires, faiblesses, étourdissements, confusion,
toux, et/ou coma. La splénomégalie est une manifestation
clinique fréquemment observée (24 %-40 % des
cas).15,16,18
Le paludisme grave est caractérisé par 1 (ou plus) des signes ou
symptômes présentés dans l'Encadré. Il est presque
invariablement causé par P falciparum, de rares cas rapportés de
paludisme grave étant causés par P
vivax.2,23-30
La confirmation diagnostique est obtenue par la mise en évidence
microscopique de parasites du paludisme sur frottis mince et goutte
épaisse, colorés par la technique de Giemsa; ces frottis doivent
être examinés dans les plus brefs délais, dans les 12
heures suivant la présentation de tout patient avec un paludisme
suspecté. Les établissements non familiarisés avec le
diagnostic de paludisme ne doivent pas retarder le diagnostic microscopique
(notamment en envoyant les frottis à un laboratoire qui ne peut pas
fournir les résultats le jour même), mais doivent rapidement
orienter le patient vers un établissement plus
expérimenté, consulter des professionnels plus compétents
d'autres structures, ainsi que les autorités sanitaires de
l'État, ou soumettre directement les images numérisées
des frottis colorés au service de télédiagnostic du CDC
(dpdx{at}cdc.gov
ou ligne ouverte 24 heures/24 du CDC ou Centre des opérations d'urgence
du CDC [Malaria Hotline, 770-488-7788 du lundi au vendredi, de 8 h à 16
h 30. Aux heures de fermeture, pendant les week-ends et les vacances
fédérales, les cliniciens du CDC peuvent être
contactés par le Centre des opérations d'urgence du CDC au
770-488-7100, qui appelle le spécialiste du paludisme de garde]).
La densité parasitaire (c'est-à-dire le pourcentage
d'érythrocytes infectés sur un frottis mince) doit être
quantifiée pour mesurer la gravité de la maladie et la
réponse au traitement, qui doit être étroitement
surveillée. Si le frottis initial est négatif alors qu'un
paludisme est suspecté, les frottis sanguins doivent être
répétés à 12 à 24 heures d'intervalle,
pendant 48 à 72 heures. Si la maladie est cliniquement suspectée
et que le diagnostic d'un laboratoire compétent est impossible, un
traitement empirique pour le paludisme à P. falciparum - selon les
indications fournies ci-après - doit être initié, en
attendant l'orientation du patient et/ou l'envoi des
prélèvements. Il est important qu'une identification
différentielle de l'espèce Babesia (qui peut être
morphologiquement similaire à P. falciparum) soit effectuée au
cours de l'examen microscopique. Bien que non spécifiques, la
thrombopénie, le faible taux de leucocytes, et des signes
d'hémolyse comme une hyperbilirubinémie, trouvés au cours
d'une analyse biologique de routine, sont des indications possibles de la
présence de paludisme. Outre la microscopie, la PCR et les tests
immunochromatographiques
rapides31
constituent des outils diagnostiques alternatifs qui ne sont pas disponibles
en routine. Les tests immunochromatographiques rapides n'ont pas encore
reçu d'approbation aux États-Unis. Les tests sérologiques
documentent une exposition passée et sont donc d'une utilité
limitée dans la prise en charge des cas aigus.
SITUATIONS CLINIQUES ET RECOMMANDATIONS THÉRAPEUTIQUES
Généralités
Afin d'assurer une bonne prise en charge du paludisme, les médecins
traitants doivent rechercher les réponses aux 5 questions suivantes:
(1) quelle est l'espèce infectante? (2) Quelle est la densité de
la parasitémie? (3) Quel est le profil de résistance dans la
région d'acquisition de l'infection? (4) Ces signes sont-ils ceux d'un
paludisme grave? et (5) Le patient peut-il prendre un traitement oral?
Les patients atteints de paludisme doivent être traités
immédiatement, dans la mesure où les infections à P.
falciparum peuvent évoluer rapidement vers une maladie grave ou le
décès en un délai aussi bref qu'un à 2
jours.32
L'immunité décroît en l'absence d'exposition
antigénique continue; en conséquence, les personnes
semi-immunisées qui retournent dans une zone endémique
après une période d'absence prolongée peuvent avoir une
susceptibilité à la forme grave de la maladie et au
décès. Si l'espèce ne peut pas être
identifiée, le patient doit être traité comme s'il
était infecté par P. falciparum jusqu'à l'identification.
L'histoire migratoire du patient fournit des indications utiles pour
sélectionner un traitement antipaludéen efficace au regard du
risque de chimiorésistance. Du fait que les correspondances entre base
et sel des traitements antipaludéens sont une source de confusion
pouvant résulter en erreurs
posologiques,33
le cas échéant, la formulation en base est suivie par
l'équivalence sel entre parenthèses
(Tableau).
|
|

|
|
Tableau.. Antipaludéens disponibles aux États-Unis et
recommandés dans le traitement du paludisme
Abréviations: G6PD, glucose-6-phosphate
déshydrogénase; IV, intraveineuse.
* La posologie pédiatrique ne doit jamais dépasser
celle de l'adulte.
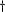 Extrapolé à partir de la littérature sur la
chloroquine. Extrapolé à partir de la littérature sur la
chloroquine.
 La méfloquine ne doit pas être utilisée pour
traiter les infections à P. falciparum contractées dans les
régions suivantes: frontières Thaïlande-Birmanie (Myanmar)
et Thaïlande-Cambodge, provinces occidentales du Cambodge, états
orientaux de la Birmanie (Myanmar), frontière Birmanie-Chine, Laos le
long des frontières du Laos et de la Birmanie (et régions
adjacentes de la frontière Thaïlande-Cambodge), et sud du Vietnam,
en raison de la présence de souches résistantes. La méfloquine ne doit pas être utilisée pour
traiter les infections à P. falciparum contractées dans les
régions suivantes: frontières Thaïlande-Birmanie (Myanmar)
et Thaïlande-Cambodge, provinces occidentales du Cambodge, états
orientaux de la Birmanie (Myanmar), frontière Birmanie-Chine, Laos le
long des frontières du Laos et de la Birmanie (et régions
adjacentes de la frontière Thaïlande-Cambodge), et sud du Vietnam,
en raison de la présence de souches résistantes.
 La capsule de quinine sulfate produite aux États-Unis est une
dose de 324 mg; en conséquence, 2 capsules doivent être
suffisantes pour la posologie adulte. La capsule de quinine sulfate produite aux États-Unis est une
dose de 324 mg; en conséquence, 2 capsules doivent être
suffisantes pour la posologie adulte.
? Nausées, vomissements, céphalées, acouphènes,
surdité, étourdissements et troubles visuels.
¶ Se référer à la notice d'information de la
quinine sulfate (Mutual Pharmaceutical Inc, Philadelphie, Pennsylvanie,
août 2005).
# Se référer à la notice de la quinidine gluconate
(Eli Lilly Co, Indianapolis, Indiana, février 2002).
|
|
|
L'utilité de l'hospitalisation initiale de tous les patients avec
paludisme à P. falciparum fait l'objet d'une certaine controverse;
certains auteurs ont tenté de définir des critères de
sélection des patients nécessitant une hospitalisation et de
ceux pouvant être suivis en
externe.34
Cependant, dans la mesure où ces patients peuvent présenter une
dégradation rapide et évoluer vers la mort en 1 à 2
jours,32 et
où de nombreux centres n'ont pas les compétences
nécessaires pour effectuer une sélection correcte
(c'est-à-dire quantifier précisément la densité
parasitaire), le CDC recommande que les patients infectés par P.
falciparum ou une espèce plasmodiale non identifiée soient
initialement hospitalisés pour s'assurer de la bonne tolérance
du traitement et de l'amélioration clinique et parasitologique du
patient. Les frottis sanguins doivent être répétés
pour vérifier la clairance de la parasitémie à P.
falciparum. Des frottis complémentaires doivent être
effectués chez les patients n'obtenant pas de réponse clinique
(avec une défervescence dans les 72 heures), et la recherche d'autres
causes de la fièvre peut également être nécessaire.
Il est à noter que les gamétocytes peuvent être moins
susceptibles que les parasites asexués à de nombreux
antipaludéens, et que leur persistance dans le sang en l'absence de
parasites asexués n'indique pas une chimiorésistance.
Paludisme à falciparum non compliqué
Pour le paludisme à P. falciparum contracté dans un nombre
limité de régions (Figure
2),4 la chloroquine (avec hydroxychloroquine en alternative de
seconde intention) reste le traitement de référence
(Tableau). Les souches P
falciparum chloroquinorésistantes se rencontrent dans toutes les autres
zones impaludées, dans lesquelles 3 options thérapeutiques sont
actuellement recommandées: (1) quinine par voie orale plus
tétracycline, doxycycline ou clindamycine; (2) atovaquone-proguanil; ou
(3) méfloquine. Les 2 premières options sont
privilégiées en raison d'un taux supérieur de
réactions neuropsychiatriques modérées à
sévères observé lors de l'utilisation de la
méfloquine aux doses
thérapeutiques35-50
comparé à son utilisation en prophylaxie. Le taux d'incidence
des effets indésirables neuropsychiatriques aux doses
thérapeutiques de la méfloquine a été
estimé de 1 sur 215 à 1 sur 1 754 traitements.39,50 Aucun des
effets indésirables neuropsychiatriques rapportés n'était
mortel, et la plupart se sont résolus
spontanément.35,37,39,41,42,46,47,50,51
L'association atovaquone-proguanil était mieux tolérée
que l'association quinine et tétracycline dans une étude
comparant directement ces deux
combinaisons.52
|
|

|
|
Figure 2.. Algorithme de traitement du paludisme
|
|
|
La quinine a un délai d'action rapide et, en association avec la
tétracycline, la doxycycline ou la clindamycine, s'est
révélée une option thérapeutique très
efficace contre les infections à P falciparum contractées dans
des régions présentant des souches
chloroquinorésistantes.52-73
Pour les infections à P. falciparum acquises en Asie du Sud-Est, une
cure de 7 jours de quinine et de l'antibiotique associé est
recommandée54,59,60,63,64,69,70,73;
pour les infections contractées en dehors du Sud-Est asiatique, une
cure de 3 jours de quinine et de 7 jours de l'antibiotique associé est
recommandée.52,53,66
La quinine et l'antibiotique doivent être initiés
simultanément ou au moins se chevaucher de 2 jours. Bien que les
études publiées sur les traitements aient principalement
utilisé la quinine en association avec la tétracycline, la
doxycycline présente une excellente efficacité
antipaludéenne dans les études de chimioprophylaxie, et est
considérée comme un traitement de substitution également
efficace.74-85
La tétracycline ou la doxycycline sont généralement
préférées à la clindamycine pour l'antibiotique
associé, en raison de données d'efficacité et d'une
expérience plus étendues. L'association quinine et clindamycine
a également démontré son efficacité contre les
infections à P. falciparum contractées dans des régions
de
chloroquinorésistance,55,58,61,62,65-69,72,86,87
et est utile dans le traitement des femmes enceintes et des enfants de moins
de 8 ans, chez lesquels la tétracycline et la doxycycline sont
contre-indiquées.
La quinine est uniquement commercialisée sous une forme orale aux
États-Unis. Le cinchonisme (un complexe de symptômes
caractérisé par des nausées, des vomissements, des
céphalées, des acouphènes, des troubles auditifs, des
étourdissements et des troubles visuels) est fréquent avec
l'utilisation de la quinine ou de la quinidine (isomère de la quinine).
Des acouphènes ont ainsi été rapportés chez 13 %
à 94 % des patients sous quinine dans des études
cliniques,52,60,65,68,69,88
et le cinchonisme a été rapporté chez 94 % des patients
dans une autre étude.63 La liaison de la quinine aux protéines
plasmatiques, principalement à l'alpha 1-glycoprotéine, est
accrue dans le
paludisme.89,90
Ceci explique pourquoi les concentrations plasmatiques de quinine qui ont
été associées à la cécité et
à la surdité après auto-intoxication, et qui sont
communes au cours du traitement du paludisme, induisent très rarement
ces effets indésirables chez les patients atteints de cette
infection.91,92
La toxicité engageant le pronostic vital est exceptionnelle, et les
symptômes de cinchonisme sont rarement suffisants pour justifier
l'arrêt du traitement par quinine ou quinidine.93 Les
tétracyclines (tétracycline et doxycycline) et la clindamycine
doivent toujours être utilisées en association avec un
antipaludéen à délai d'action plus rapide, comme la
quinine, et jamais en monothérapie.
Des taux de guérison de 94 % à 100 % ont été
rapportés pour l'atovaquone-proguanil dans le traitement des infections
à P. falciparum contractées en Asie du Sud-Est, en Afrique et en
Amérique du
Sud.52,94-109
À ce jour, 12 cas d'échec sous atovaquone-proguanil ont
été publiés dans le traitement du paludisme à P.
falciparum (d'Afrique orientale, occidentale et centrale), dont 7
présentaient des isolats avec des marqueurs de résistance
génétiquement confirmés (mutations dans le gène du
cytochrome
b);110-117
en conséquence, les cliniciens doivent rester conscients de la
possibilité rare d'échecs thérapeutiques avec
l'atovaquone-proguanil. La méfloquine ne doit pas être
utilisée pour traiter les infections à P falciparum
contractées dans les régions frontalières
Thaïlande-Birmanie (Myanmar) et Thaïlande-Cambodge, dans les
provinces occidentales du Cambodge, dans les états orientaux de la
Birmanie (Myanmar), dans les zones frontalières de la Birmanie et de la
Chine, au Laos le long des frontières du Laos et de la Birmanie ainsi
que dans les régions adjacentes de la frontière
Thaïlande-Cambodge, et dans le Sud du Vietnam, en raison d'une forte
prévalence de P. falciparum résistant à la
méfloquine rapportée dans ces
zones.118
Bien que la méfloquine soit contreindiquée en
chimioprophylaxie chez les personnes ayant une histoire actuelle ou
récente de dépression, de trouble d'anxiété
généralisée, de psychose, ou d'autre trouble
psychiatrique majeur, ainsi que chez les personnes ayant une histoire
d'épilepsie, elle peut être utilisée dans le traitement
des patients présentant ces troubles s'il est estimé que les
bénéfices surpassent les
risques.119
Si une molécule apparentée (chloroquine, quinine ou quinidine) a
été administrée en chimioprophylaxie ou en traitement
initial, l'administration de méfloquine doit être espacée
d'au moins 12 heures après la dernière dose de cette
molécule, afin de minimiser le risque d'événements
indésirables, notamment d'anomalies
électrocardiographiques.119,120
Les traitements antipaludéens qui ne sont pas recommandés, en
raison de problèmes de résistance et/ou de toxicité -
malgré leur disponibilité éventuelle dans d'autres pays -
incluent la sulfadoxine-pyriméthamine, l'amodiaquine, et
l'halofantrine.
Paludisme non-falciparum non compliqué
La chloroquine reste le traitement de référence pour toutes
les infections à P. malariae et P. ovale, ainsi que pour celles
à P. vivax contractées en dehors de la
Papouasie-Nouvelle-Guinée et de l'Indonésie;
l'hydroxychloroquine est une alternative de seconde intention. Actuellement,
il existe des données limitées concernant les options
thérapeutiques optimales pour les infections à P. vivax
contractées dans des zones de chloroquino-résistance fortement
prévalente (Papouasie-Nouvelle-Guinée et Indonésie). La
meilleure option pourrait être l'atovaquone-proguanil, avec la
méfloquine ou la quinine plus tétracycline ou doxycycline en
alternatives. La quinine (3 jours), associée à la
tétracycline ou la doxycycline (7
jours),121-128
comme la
méfloquine129-135
ont été utilisées avec succès par le passé
dans des observations ou des petites séries de cas. Plus
récemment, l'atovaquone-proguanil, dans une étude relativement
petite,99 et
la méfloquine (à 15 mg/kg)136 ont démontré leur
efficacité dans le traitement du paludisme à P. vivax en
Indonésie, où des taux élevés de P. vivax
chloroquinorésistant sont recensés. Il est à noter que
bien que les premières études sur l'atovaquone-proguanil aient
montré des taux élevés (68 %) de parasitémie
récurrente avant 28 jours de suivi,101 (dont certaines peuvent avoir
été des rechutes), des études ultérieures (bien
que de petite taille) ont démontré une excellente
efficacité (> 95 %) de l'atovaquone-proguanil contre le paludisme
à P.
vivax.99,137
Les données sont trop limitées pour recommander l'association
quinine-clindamycine69
en première ligne de traitement des infections à P. vivax,
incluant celles avec chloroquino-résistance. Baird et coll ont
démontré une efficacité de 85 % de la chloroquine et de
la primaquine à forte dose (2,5 mg base/kg sur 3 jours) dans le
traitement du paludisme à P. vivax
chloroquinorésistant.138
Le CDC ne recommande pas cette association en raison d'une inexpérience
relative avec la primaquine à forte dose et d'une efficacité
suboptimale. Les infections à P. vivax et P. ovale doivent être
traitées par primaquine afin de prévenir les rechutes
potentielles. Afin d'obtenir une éradication plus fiable des
hypnozoïtes, le CDC recommande désormais un schéma de 0,5
mg/kg à un maximum de 30 mg base de primaquine, quotidiennement pendant
14 jours. L'effet indésirable grave le plus fréquent
associé à la primaquine est l'hémolyse intravasculaire
chez les personnes ayant un déficit en G6PD (glucose-6-phosphate
déshydrogénase) - une contre-indication à l'utilisation
de ce médicament. Un test de dépistage de ce déficit doit
être réalisé chez les patients avant l'utilisation de la
primaquine. Le traitement par primaquine doit, dans la mesure du possible,
être simultané au traitement schizonticide
sanguin.138-140
Les patients qui ne peuvent pas prendre de primaquine doivent être
informés de la possibilité d'une infection récurrente
(estimée à environ 20 % [étendue, 5 %-80 %])5 et de la
nécessité de rechercher un traitement si des symptômes
similaires réapparaissent. Une autre option potentielle pour les
patients qui ne peuvent pas prendre de primaquine et qui présentent des
rechutes fréquentes, est la prophylaxie par chloroquine (ou
méfloquine dans le cas de P. vivax chloroquinorésistant) pendant
la période où les rechutes sont le plus susceptible de survenir
(soit quelques années). Bien que l'atovaquone-proguanil ait une <<
activité prophylactique causale >> (c'est-à-dire une
capacité de prévenir l'infection au stade sanguin en tuant les
parasites en développement dans la phase hépatique), elle ne
semble pas éradiquer les
hypnozoïtes101,102
et pourrait ne pas empêcher leur
persistance.141,142
En conséquence, les patients atteints de paludisme à P. vivax ou
P. ovale qui ont été traités par atovaquone-proguanil
nécessitent également un traitement par primaquine. Bien qu'un
schéma thérapeutique modifié de 45 mg (base) de
primaquine hebdomadaire pendant 8 semaines ait été
suggéré en alternative pour les patients ayant un léger
déficit en
G6PD,143,144
ses données d'innocuité et d'efficacité sont très
limitées. L'utilisation de la primaquine en << traitement curatif
radical >> (primaquine associée à un schizonticide sanguin
efficace pour le traitement d'un paludisme à P. vivax ou P. ovale) chez
un individu ayant un déficit connu en G6PD ne doit se faire
qu'après une évaluation soigneuse des risques et des
bénéfices, et sous une étroite surveillance
médicale.140
Paludisme grave
La mesure la plus importante dans la prise en charge du paludisme grave est
l'initiation immédiate d'un traitement parentéral adapté.
Aux États-Unis, le seul médicament actuellement disponible sous
forme parentérale est la quinidine gluconate. Les frottis sanguins
doivent être examinés toutes les 12 heures jusqu'à
l'obtention d'un résultat négatif pour les parasites du
paludisme.91
La densité parasitaire diminue généralement de 90 % au
cours des premières 48 heures sous traitement par quinine ou
quinidine.145-149
Si la parasitémie n'a pas diminué selon les prévisions,
les causes potentielles doivent en être recherchées (notamment en
vérifiant la concentration de quinidine). Les concentrations de
quinidine doivent être maintenues dans l'intervalle de 3 à 8
mg/L.91,150
La quinidine est plus cardiotoxique que la quinine et doit être
administrée en unité de soins intensifs, avec une surveillance
électrocardiographique continue et une mesure fréquente de la
pression
artérielle.145
Les effets indésirables cardiovasculaires associés à la
quinidine sont potentiellement graves et peuvent être plus
fréquents si le médicament est administré
rapidement.151
Le risque de cardiotoxicité augmente avec la bradycardie,
l'hypokaliémie, et
l'hypomagnésémie,152
et en cas d'administration d'autres médicaments susceptibles d'allonger
l'intervalle QTc (quinine, méfloquine ou antibiotiques macrolides, par
exemple).
Du fait que des antiarythmiques plus récents ont supplanté la
quinidine gluconate, la quinidine est souvent indisponibles dans de nombreux
hôpitaux.152-154
Les pharmacies des hôpitaux devraient maintenir ou ajouter la quinidine
gluconate dans leur liste de médicaments. S'ils ne stockent pas le
médicament, ils doivent être en mesure de localiser
immédiatement une source proche. Dans le cas contraire, l'hôpital
doit contacter son distributeur local ou régional pour demander le
médicament ou contacter directement la société Eli Lilly
Co (téléphone:
1-800-821-0538).152
La société peut organiser une expédition rapide du
médicament entre 6 h 00 et 18 h 00. Si une assistance
complémentaire est nécessaire dans la prise en charge de
patients atteints de paludisme, les professionnels de santé peuvent
contacter la ligne ouverte 24 H/24 du CDC.
Dans la mesure où la majorité des décès de
paludisme grave survient dans les premières 24 à 48 heures de
traitement, une dose d'attaque initiale de quinidine est recommandée
pour atteindre les doses curatives aussi rapidement que
possible,145,155,156
à moins que le patient ait reçu plus de 40 mg/kg de quinine dans
les 2 jours précédents ou de la méfloquine au cours des
12 dernières heures (auquel cas la dose d'attaque est remplacée
par une perfusion continue de
quinidine).93
La perfusion de quinidine doit être temporairement ralentie ou
arrêtée en cas d'augmentation de l'intervalle QT à plus de
0,6 secondes, d'augmentation du complexe QRS à plus de 50 %,
d'allongement de l'intervalle QTc de plus de 25 % de la valeur initiale, ou de
développement d'une hypotension ne répondant pas à la
charge de
liquide.150,155
Si les modifications électrocardiographiques significatives persistent
ou si une arythmie maligne se développe, les médecins doivent
traiter les arythmies et envisager la consultation de spécialistes par
la ligne ouverte du CDC pour le paludisme ou d'autres spécialistes des
maladies tropicales. Dans ces situations graves, les options peuvent inclure
l'administration de médicaments antipaludéens alternatifs par
sonde nasogastrique, parallèlement à une exsanguinotransfusion.
La perfusion continue de quinidine doit être poursuivie pendant la
transfusion.
Les doses initiales (incluant celle d'attaque) de quinine ou de quinidine
par voie parentérale ne doivent pas être réduites chez les
personnes présentant une insuffisance rénale. Les
propriétés pharmacocinétiques des alcaloïdes du
quinquina sont altérées dans le paludisme, avec une contraction
du volume de distribution proportionnelle à la gravité de la
maladie.91,157
En cas de persistance de l'insuffisance rénale ou d'absence
d'amélioration de l'état clinique du patient, la dose
d'entretien doit être réduite d'un tiers à la
moitié, au troisième jour de
traitement.91
Les dérivés de l'artémisinine éliminent
très rapidement les parasites et sont aujourd'hui un
élément clé du traitement du paludisme dans le monde; ils
ont démontré une réduction de la mortalité dans le
paludisme grave comparé à la quinine sous forme
parentérale.158 Ces médicaments ne sont pas encore disponibles
aux États-Unis, mais le CDC espère obtenir la mise à
disposition de l'artésunate intraveineuse dans le cadre d'un protocole
IND (Investigational New Drug) en 2007.
L'exsanguinotransfusion est utilisée dans le traitement du paludisme
grave depuis 1974 avec des bénéfices
apparents,145,159,160
potentiellement dus à une réduction rapide de la
parasitémie par élimination directe des parasites, une
réduction des dérivés toxiques, et/ou une
amélioration de la rhéologie avec les cellules
transfusées.161,162
Les aspects techniques de l'exsanguinotransfusion ont été
présentés dans une excellente revue publiée par Powell et
Grima.162
Cependant, l'exsanguinotransfusion et ses indications resteront
controversées jusqu'à ce qu'une étude comparative
suffisamment puissante et soigneusement contrôlée soit
effectuée, ce qui semble peu
probable.163,164
Dans la décision d'utiliser l'exsanguinotransfusion, les risques
potentiels, incluant la surcharge liquidienne, les réactions
fébriles et allergiques, les troubles métaboliques, la
sensibilisation d'alloanticorps anti-hématies, l'infection
transmissible, l'hémorragie cérébrale et la
septicémie, doivent être évalués contre les
bénéfices
potentiels.163
Le CDC recommande que l'exsanguinotransfusion soit fortement envisagée
chez les personnes ayant une parasitémie supérieure à 10
% ou en présence de complications telles qu'un neuropaludisme, un
œdème pulmonaire sans surcharge volémique, ou une atteinte
rénale.150
Divers traitements adjuvants apparaissent dans la littérature;
cependant, compte tenu de leur efficacité non démontrée
ou de leurs effets délétères dans le traitement du
paludisme grave, ils ne sont pas recommandés actuellement. Ces
traitements incluent le phénobarbital pour la prophylaxie des crises
d'épilepsie,165-167
la dexaméthasone pour le traitement du paludisme
cérébral,156,168,169
l'héparine pour le traitement de la thrombopénie et/ou de la
fibrinogénémie,170-176
les chélateurs du fer destinés à réduire le
délai d'élimination des
parasites,125,177,178
la pentoxifylline pour l'inhibition de la synthèse de TNF (tumor
necrosis
factor),179
et le dichloroacétate pour le traitement de l'acidose
métabolique.180
Les complications potentielles du paludisme grave181 doivent être
reconnues et traitées. L'hypoglycémie peut être
masquée par les manifestations du paludisme cérébral; en
conséquence, le dosage fréquent du glucose plasmatique est
essentiel. L'hypoglycémie sévère et récurrente
peut être causée par l'hyperinsulinémie induite par la
quinine ou la quinidine, par l'endotoxine ou par la consommation des
parasites.182,183
L'hyperthermie peut être traitée par paracétamol; les
anti-inflammatoires non stéroïdiens ne sont pas
recommandés, compte tenu de la fréquence des
thrombopénies et des anomalies de la coagulation. L'œdème
pulmonaire peut être dû à une surcharge liquidienne ou au
syndrome de détresse respiratoire de l'adulte, et peut être
minimisé en maintenant l'euvolémie des patients. L'insuffisance
rénale aiguë est généralement oligurique. Avec la
dialyse, on peut espérer une récupération de la fonction
rénale après une médiane de 4 jours, bien que certains
patients puissent nécessiter une dialyse pendant 2 à 3
semaines.184
La thrombopénie est fréquente dans le paludisme grave. Les
signes biologiques de coagulation activée sont plus fréquents
que la coagulation intravasculaire disséminée avec
hémorragie.181,185,186
L'hyponatrémie,187
l'hypocalcémie, l'hypophosphatémie et
l'hyperphosphatémie, ainsi que l'hypomagnésémie et
l'hypermagnésémie,188
ont toutes été rapportées chez des patients avec
paludisme à P.
falciparum.181
Chez les patients avec un paludisme cérébral suspecté,
une ponction lombaire doit être effectuée pour exclure la
méningite
bactérienne,157
et un examen en imagerie par résonance magnétique ou tomographie
doit être réalisé pour exclure l'hémorragie
intracérébrale, l'oedème cérébral, et la
hernie cérébrale/médullaire. La plupart des patients
survivant d'un paludisme cérébral reprennent conscience dans les
2 à 3 jours, bien qu'un délai de plus d'une semaine puisse
parfois être
nécessaire.189
Paludisme provoqué
Dans la mesure où le paludisme contracté par voie sanguine
(notamment par transfusion sanguine ou transplantation d'organe) ne
présente pas de phase exoérythrocytaire, le traitement par
primaquine n'est pas nécessaire dans les infections à P vivax ou
P ovale provoquées.
Automédication
Le CDC recommande aux personnes se rendant dans des zones impaludées
d'utiliser une prophylaxie du paludisme plutôt qu'une
automédication. Cependant, les voyageurs qui décident de ne pas
prendre de prophylaxie, ceux qui ne choisissent pas un régime
thérapeutique optimal (chloroquine pour un séjour dans une zone
d'endémie palustre à P. falciparum chloroquino-résistant
par exemple), ou ceux qui requièrent une combinaison
thérapeutique sous-optimale présentent un risque
supérieur de contracter l'infection et de nécessiter un
traitement rapide. Les voyageurs qui prennent une prophylaxie efficace mais
qui se trouveront dans des zones très reculées peuvent
décider, en concertation avec leur médecin, de prendre
parallèlement une dose d'antipaludéen automédication. Le
seul traitement recommandé en automédication pour les voyageurs
américains est l'atovaquone-proguanil. Il ne doit pas être
utilisé chez les patients sous prophylaxie par atovaquone-proguanil, en
raison du risque de recrudescence de la parasitémie due à un
organisme résistant chez ces patients. Dans ces cas, une consultation
spécialisée en médecine tropicale doit être
recherchée. La quinine-doxycycline est une alternative sous-optimale en
raison de ses effets indésirables potentiels et de la complexité
de l'association. Il doit donc être rappelé aux voyageurs que
l'automédication pour une infection plasmodiale potentielle ne
constitue qu'une mesure temporaire, et qu'une évaluation
médicale rapide est
impérative.4
Le paludisme chez l'enfant
La tétracycline et la doxycycline ont une contre-indication relative
dans l'utilisation chez les nourrissons et les enfants de moins de 8 ans, en
raison de données rapportant des dépôts dans des zones de
calcification des os et des dents qui résultent en une coloration
permanente des dents, une hypoplasie de l'émail, et une diminution de
la croissance squelettique
linéaire.190,191
L'utilisation de la clindamycine en association avec la quinine doit donc
être privilégiée. Bien que la notice d'information
américaine recommande l'utilisation de la méfloquine chez
l'enfant de plus de 6
mois,119
cette molécule est généralement bien
tolérée chez les enfants de plus de 5
kg,192-195
le principal effet indésirable étant des
vomissements.192-196
Bien que peu d'études documentent l'innocuité et la
tolérance de la primaquine chez l'enfant, elle a été
utilisée pendant plus de 50 ans sans problèmes
d'innocuité apparents. Il n'existe pas de données
suggérant que le médicament ne peut pas être
utilisé chez l'enfant, quel que soit son âge, en l'absence de
déficit en
G6PD.140 Ni
l'American Academy of Pediatrics ni les autorités de santé
américaines4 ou
canadiennes197
ne définissent de limite d'âge minimale pour l'utilisation de la
primaquine.
Le paludisme chez la femme enceinte
Le paludisme chez la femme enceinte est associé à des risques
élevés de morbidité et de mortalité maternelles et
périnatales, incluant la fausse-couche, la mortinatalité,
l'accouchement prématuré, le faible poids de naissance,
l'infection congénitale, et/ou le décès néonatal.
Pour les infections à P. falciparum non compliquées
contractées dans des régions de souches
chloroquinorésistantes, il a été démontré
que l'association quinine plus clindamycine était sans risque et
efficace; elle est donc
recommandée.65
Les questions concernant la toxicité fœtale ou le
déclenchement du travail, potentiellement causés par la quinine
administrée tardivement dans la grossesse, n'ont pas été
justifiées aux doses utilisées dans le traitement du
paludisme.198
Un effet indésirable majeur de la quinine chez la femme enceinte est
l'hyperinsulinémie, qui peut précipiter ou aggraver
l'hypoglycémie.198
En fin de grossesse, la quinine est délivrée au
fœtus, ce qui soulève des inquiétudes concernant la
libération d'insuline déclenchée par la quinine, qui
entraînerait une hypoglycémie
fœtale.182
Cependant, les risques générés par le paludisme
falciparum non traité pendant la grossesse surpassent le risque
potentiel d'effets indésirables induits par la quinine ou la
quinidine.
L'atovaquone-proguanil et la méfloquine ne sont pas
recommandées actuellement dans le traitement de la femme enceinte et ne
doivent être utilisées que si l'association quinine plus
clindamycine ou la quinine en monothérapie sont indisponibles ou non
tolérées. La tétracycline et la doxycycline sont
contre-indiquées. Bien que 2 études récentes sur
l'association atovaquone-proguanil et artésunate dans le traitement des
infections à P. falciparum chez les femmes enceintes aient
démontré une bonne tolérance, sans suggérer de
toxicité pour la mère ou le
fœtus,199,120
des études complémentaires seront nécessaires avant de
pouvoir recommander l'utilisation de l'atovaquone-proguanil au cours de la
grossesse.
La primaquine pouvant potentiellement causer une maladie hémolytique
chez un fœtus carencé en G6PD, elle est
contre-indiquée pendant la grossesse. Les femmes enceintes
traitées pour des infections à P. ovale et P. vivax doivent
également recevoir une chimioprophylaxie jusqu'à l'accouchement.
L'association prophylactique devra se composer de chloroquine, 300 mg base (=
500 mg sel) par voie orale une fois par semaine ou, pour les infections
à P. vivax contractées dans des zones de souches
chloroquino-résistantes, de méfloquine à la dose de 228
mg base (= 250 mg sel) par voie orale une fois par semaine. Alors que la
méfloquine n'est pas recommandée dans le traitement du paludisme
chez la femme
enceinte,201
plusieurs études soutiennent son innocuité en chimioprophylaxie
pendant la
grossesse.202-206
Après l'accouchement, les femmes doivent être traitées par
primaquine selon les recommandations concernant la population
générale adulte.
Paludisme congénital
Environ 2 cas de paludisme congénital sont rapportés aux
États-Unis chaque année. Les nourrissons âgés de 1
à 2 mois se présentent généralement avec de la
fièvre, une anémie, un retard de développement, et une
splénomégalie. Comme avec le paludisme provoqué, il n'y a
pas de phase exoérythrocytaire et en conséquence pas de besoin
de traitement par primaquine dans les infections congénitales à
P. vivax ou P. ovale. Pour les mères en phase parasitémique,
pendant la grossesse ou à l'accouchement, les cliniciens doivent
décider de la prise en charge du nourrisson au cas par cas, en prenant
notamment en compte la fiabilité du suivi et l'accès aux soins
médicaux. Dans certains cas, il peut être approprié de
simplement éduquer la mère quant aux risques de paludisme
congénital et de lui recommander de rechercher des soins
médicaux si le nourrisson développe des symptômes de
paludisme. Dans d'autres cas, le traitement présomptif du
nouveau-né peut être justifié.
Assistance clinique et notification
Le CDC présente des recommandations thérapeutiques mises
à jour sur son site Internet, à l'adresse
www.cdc.gov/malaria,
et dispose de cliniciens de garde 24 heures/24 pour fournir des conseils aux
cliniciens sur le diagnostic et le traitement du paludisme. Le paludisme est
une maladie à déclaration obligatoire nationale, et tous les cas
doivent être rapportés à l'autorité sanitaire de
l'état concerné. La déclaration des cas est essentielle
pour surveiller les tendances dans la contraction de l'infection et pour
élaborer des recommandations en matière de chimioprophylaxie et
de
traitement.2,207-209
CONCLUSIONS
Le paludisme restera un défi diagnostique et thérapeutique
pour les cliniciens américains, à mesure que s'accroît le
nombre de déplacements à destination et en provenance de zones
impaludées. Dans une revue portant sur l'ensemble des
décès dus au paludisme aux États-Unis de 1963 à
2001, les facteurs essentiels contribuant aux décès liés
au paludisme étaient le non-diagnostic de la maladie lors de la
présenta tion initiale, l'absence d'initiation rapide d'un traitement
après le diagnostic, et/ou l'absence de prescription d'un
antipaludéen
adapté.2
Les cliniciens doivent rester vigilants face à
l'éventualité de cette maladie et prendre des mesures
immédiates pour permettre un diagnostic et un traitement rapides et
adéquats.
Informations sur les auteurs
Correspondance: Monica E. Parise, MD, Parasitic Diseases Branch,
Division of Parasitic Diseases, National Center for Zoonotic, Vector-Borne and
Enteric Diseases, Centers for Disease Control and Prevention, 4770 Buford Hwy
NE MS F22, Atlanta, GA 30341
(MParise{at}cdc.gov).
*References 35,
37,
39,
41,
42,
46,
47,
50,
51.
 References 55,
58,
61,
62,
65-69,
72,
86,
87. References 55,
58,
61,
62,
65-69,
72,
86,
87.
FMC disponible en ligne à
www.jama.com
Rédacteur en chef de la section Revue Clinique: Michael S.
Lauer, MD. Nous encourageons les auteurs à presenter leurs articles en
vue d'acceptation dans Revue Clinique. Prière de contacter Michael S.
Lauer, MD, à
lauerm{at}ccf.org
Contributions des auteurs: Les Drs Griffith, Lewis, et Parise ont eu
un accès complet à toutes les données de l'étude
et acceptent la responsabilité de l'intégrité des
données et de l'exactitude de l'analyse des données.
Conception et schéma de l'étude: Griffith, Lewis,
Parise.
Recueil des données: Griffith, Lewis, Mali, Parise.
Analyse et interprétation des données: Griffith,
Lewis, Parise.
Rédaction du manuscrit: Griffith, Lewis, Parise.
Revue critique du manuscrit: Griffith, Lewis, Mali, Parise.
Aide administrative, technique et matérielle: Griffith,
Lewis, Mali.
Supervision de l'étude: Parise.
Liens financiers: Aucun déclaré.
Note: les observations et conclusions de ce rapport sont deux des
auteurs et ne reflètent pas nécessairement les idées des
Centers for Disease Control and Prevention.
Remerciements: Nous remercions Phuc Nguyen-Dinh, MD, MPH, Malaria
Branch, Division of Parasitic Diseases, Centers for Disease Control and
Prevention (retraité depuis février 2007), pour sa revue
approfondie et ses commentaires sur le manuscrit. Il n'a reçu aucune
compensation financière pour sa contribution.
Affiliations des auteurs: Malaria Branch, Division of Parasitic
Diseases, National Center for Zoonotic,Vector-Borne and EntericDiseases,
Coordinating Center for Infectious Diseases, Centers for Disease Control and
Prevention, Atlanta, Ga; Butte County Department of Public Health,Oroville,
Calif. Le Dr Griffith est actuellement au Bacterial Diseases Branch, Division
of Vector Borne Infectious Diseases, National Center for Zoonotic,
Vector-Borne and Enteric Diseases, Coordinating Center for Infectious
Diseases, Centers for Disease Control and Prevention. Le Dr Parise est
actuellement au Parasitic Diseases Branch, Division of Parasitic Diseases,
National Center for Zoonotic, Vector-Borne and Enteric Diseases, Centers for
Disease Control and Prevention.
BIBLIOGRAPHIE
 |  |
1. Skarbinski J, James EM, Causer LM, et al. Malaria
surveillance-United States, 2004. MMWR Surveill Summ.2006; 55:23
-37.
PUBMED
2. Newman RD, Parise ME, Barber AM, Steketee RW. Malaria-related
deaths among U.S. travelers, 1963-2001. Ann Intern
Med. 2004;141:547
-555.
FREE FULL TEXT
3. Mendis K, Sina BJ, Marchesini P, Carter R. The neglected burden of
Plasmodium vivax malaria. Am J Trop Med Hyg.2001; 64(1-2 suppl):97
-106.
FREE FULL TEXT
4. Health Information for International Travel
2005-2006. Atlanta, Ga: Elsevier Inc;2005
.5. Baird JK, Hoffman SL. Primaquine therapy for malaria.
Clin Infect Dis.2004; 39:1336
-1345.
FREE FULL TEXT
6. Marlar T, Myat Phone K, Aye Yu S, Khaing Khaing G, Ma S, Myint O.
Development of resistance to chloroquine by Plasmodium vivax in Myanmar.
Trans R Soc Trop Med Hyg.1995; 89:307
-308.
PUBMED
7. Jamaiah I, Anuar AK, Najib NA, Zurainee MN. Imported malaria: a
retrospective study in University Hospital, Kuala Lumpur, a ten-year
experience. Med J Malaysia.1998; 53:6
-9.
PUBMED
8. Phan GT, De Vries PJ, Tran BQ, et al. Artemisinin or chloroquine
for blood stage Plasmodium vivax malaria in Vietnam. Trop Med Int
Health. 2002;7:858
-864.
PUBMED
9. Singh RK. Emergence of chloroquine-resistant vivax malaria in south
Bihar (India). Trans R Soc Trop Med Hyg.2000; 94:327
.
PUBMED
10. Kurcer MA, Simsek Z, Kurcer Z. The decreasing efficacy of
chloroquine in the treatment of Plasmodium vivax malaria, in Sanliurfa,
south-eastern Turkey. Ann Trop Med Parasitol.2006; 100:109
-113.
PUBMED
11. Kurcer MA, Simsek Z, Zeyrek FY, et al. Efficacy of chloroquine in
the treatment of Plasmodium vivax malaria in Turkey. Ann Trop Med
Parasitol. 2004;98:447
-451.
PUBMED
12. Sinden REG. The malaria parasites. In: Warrell DA, Gilles HM, eds.
Essential Malariology. 4th ed. London, England:
Arnold; 2002:26,30
.
13. Molineaux L. The epidemiology of human malaria as an explanation of
its distribution, including some implications for its control. In: Wernsdorfer
WH, ed. Malaria, Principles and Practice of Malariology, Volume
2. Edinburgh, Scotland: Churchill Livingstone; 1988:927
.14. Garnham P. Malaria parasites of man: life-cycles and morphology.
In: Wernsdorfer WH, McGregor I, eds. Malaria: Principles and
Practice of Malariology, Volume 1. London, England: Churchill
Livingstone; 1988: 69.15. Dorsey G, Gandhi M, Oyugi JH, Rosenthal PJ. Difficulties in the
prevention, diagnosis, and treatment of imported malaria. Arch
Intern Med. 2000;160:2505
-2510.
FREE FULL TEXT
16. Moore TA, Tomayko JF Jr, Wierman AM, Rensimer ER, White AC Jr.
Imported malaria in the 1990s: a report of 59 cases from Houston, Tex.
Arch Fam Med.1994; 3:130
-136.
FREE FULL TEXT
17. Singh K, Wester WC, Trenholme GM. Problems in the therapy for
imported malaria in the United States. Arch Intern
Med. 2003;163:2027
-2030.
FREE FULL TEXT
18. Svenson JE, MacLean JD, Gyorkos TW, Keystone J. Imported malaria:
clinical presentation and examination of symptomatic travelers.
Arch Intern Med.1995; 155:861
-868.
FREE FULL TEXT
19. Lynk A, Gold R. Review of 40 children with imported malaria.
Pediatr Infect Dis J.1989; 8:745
-750.
PUBMED
20. McCaslin RI, Pikis A, Rodriguez WJ. Pediatric Plasmodium
falciparium malaria: a ten-year experience from Washington, DC.
Pediatr Infect Dis J.1994; 13:709
-715.
PUBMED
21. World Health Organization. WHO Guidelines for the
Treatment of Malaria. Geneva, Switzerland: WHO Press;2000
.22. World Health Organization. WHO Guidelines for the
Treatment of Malaria. Geneva, Switzerland: WHO Press;2006
.23. Beg MA, Khan R, Baig SM, Gulzar Z, Hussain R, Smego RA Jr. Cerebral
involvement in benign tertian malaria. Am J Trop Med
Hyg. 2002;67:230
-232.
ABSTRACT
24. Curlin ME, Barat LM, Walsh DK, Granger DL. Non-cardiogenic
pulmonary edema during vivax malaria. Clin Infect Dis.1999; 28:1166
-1167.
FREE FULL TEXT
25. Islam N, Qamruddin K. Unusual complications in benign tertian
malaria. Trop Geogr Med.1995; 47:141
-143.
PUBMED
26. Kochar DK, Saxena V, Singh N, Kochar SK, Kumar SV, Das A.
Plasmodium vivax malaria. Emerg Infect Dis.2005; 11:132
-134.
PUBMED
27. Muhlberger N, Jelinek T, Gascon J, et al. Epidemiology and clinical
features of vivax malaria imported to Europe: sentinel surveillance data from
TropNetEurop. Malar J.2004; 3:5
.
PUBMED
28. Sachdev HS, Mohan M. Vivax cerebral malaria. J Trop
Pediatr. 1985;31:213
-215.
FREE FULL TEXT
29. Tanios MA, Kogelman L, McGovern B, Hassoun PM. Acute respiratory
distress syndrome complicating Plasmodium vivax malaria. Crit Care
Med. 2001; 29:665
-667.
PUBMED
30. Zingman BS, Viner BL. Splenic complications in malaria: case report
and review. Clin Infect Dis. 1993;16
: 223-232.
FREE FULL TEXT
31. Moody A. Rapid diagnostic tests for malaria parasites.
Clin Microbiol Rev.2002; 15:66
-78.
FREE FULL TEXT
32. Greenwood BM, Bradley AK, Greenwood AM, et al. Mortality and
morbidity from malaria among children in a rural area of The Gambia, West
Africa. Trans R Soc Trop Med Hyg.1987; 81:478
-486.
PUBMED
33. Kain KC, Gadd E, Gushulak B, McCarthy A, MacPherson D. Errors in
treatment recommendations for severe malaria. Committee to Advise on Tropical
Medicine and Travel (CATMAT). Lancet.1996; 348:621
-622.
PUBMED
34. D'Acremont V, Landry P, Mueller I, Pecoud A, Genton B. Clinical and
laboratory predictors of imported malaria in an outpatient setting: an aid to
medical decision making in returning travelers with fever. Am J
Trop Med Hyg. 2002;66:481
-486.
ABSTRACT
35. Caillon E, Schmitt L, Moron P. Acute depressive symptoms after
mefloquine treatment. Am J Psychiatry.1992; 149:712
.
PUBMED
36. Ekue JM, Simooya OO, Sheth UK, Wernsdorfer WH, Njelesani EK. A
double-blind clinical trial of a combination of mefloquine, sulfadoxine and
pyrimethamine in symptomatic falciparum malaria. Bull World Health
Organ. 1985;63:339
-343.
PUBMED
37. Harinasuta T, Bunnag D, Wernsdorfer WH. A phase II clinical trial
of mefloquine in patients with chloroquine-resistant falciparum malaria in
Thailand. Bull World Health Organ.1983; 61:299
-305.
PUBMED
38. Hennequin C, Bouree P, Bazin N, Bisaro F, Feline A. Severe
psychiatric side effects observed during prophylaxis and treatment with
mefloquine. Arch Intern Med.1994; 154:2360
-2362.
FREE FULL TEXT
39. Luxemburger C, Nosten F, ter Kuiile F, Frejacques L,
Chongsuphajaisiddhi T, White NJ. Mefloquine for multidrug-resistant malaria.
Lancet. 1991;338:1268
.
PUBMED
40. Marsepoil T, Petithory J, Faucher JM, Ho P, Viriot E, Benaiche F.
Encephalopathy and memory disorders during treatments with mefloquine [article
in French]. Rev Med Interne.1993; 14:788
-791.
PUBMED
41. Patchen LC, Campbell CC, Williams SB. Neurologic reactions after a
therapeutic dose of mefloquine. N Engl J Med.1989; 321:1415
-1416.
PUBMED
42. Phillips-Howard PA, ter Kuile FO. CNS adverse events associated
with antimalarial agents: fact or fiction? Drug Saf.1995; 12:370
-383.
PUBMED
43. Price R, van Vugt M, Phaipun L, et al. Adverse effects in patients
with acute falciparum malaria treated with artemisinin derivatives.
Am J Trop Med Hyg.1999; 60:547
-555.
ABSTRACT
44. Rendi-Wagner P, Noedl H, Wernsdorfer WH, Wiedermann G, Mikolasek A,
Kollaritsch H. Unexpected frequency, duration and spectrum of adverse events
after therapeutic dose of mefloquine in healthy adults. Acta
Trop. 2002;81:167
-173.
PUBMED
45. Rouveix B, Bricaire F, Michon C, et al. Mefloquine and an acute
brain syndrome. Ann Intern Med.1989; 110:577
-578.
FREE FULL TEXT
46. Sowunmi A. Acute psychosis after mefloquine: a case report.
East Afr Med J.1994; 71:818
-819.
PUBMED
47. Sowunmi A, Adio RA, Oduola AM, Ogundahunsi OA, Salako LA. Acute
psychosis after mefloquine: report of six cases. Trop Geogr
Med. 1995;47:179
-180.
PUBMED
48. Sowunmi A, Salako LA, Oduola AM, Walker O, Akindele JA, Ogundahunsi
OA. Neuropsychiatric side effects of mefloquine in Africans. Trans
R Soc Trop Med Hyg. 1993;87:462
-463.
PUBMED
49. Speich R, Haller A. Central anticholinergic syndrome with the
antimalarial drug mefloquine. N Engl J Med.1994; 331:57
-58.
PUBMED
50. Weinke T, Trautmann M, Held T, et al. Neuropsychiatric side effects
after the use of mefloquine. Am J Trop Med Hyg.1991; 45:86
-91.
FREE FULL TEXT
51. Stuiver PC, Ligthelm RJ, Goud TJ. Acute psychosis after mefloquine.
Lancet. 1989;2:282
.
PUBMED
52. de Alencar FE, Cerutti C Jr, Durlacher RR, et al. Atovaquone and
proguanil for the treatment of malaria in Brazil. J Infect
Dis. 1997;175:1544
-1547.
FREE FULL TEXT
53. Barata LC, Boulos M, Dutra AP. Use of tetracycline and quinine
combination in the treatment of Plasmodium falciparum malaria [article in
Portuguese]. Rev Soc Bras Med Trop.1986; 19:135
-137.
PUBMED
54. Bunnag D, Karbwang J, Na-Bangchang K, Thanavibul A, Chittamas S,
Harinasuta T. Quinine-tetracycline for multidrug resistant falciparum malaria.
Southeast Asian J Trop Med Public Health.1996; 27:15
-18.
PUBMED
55. Clyde DF, Gilman RH, McCarthy VC. Antimalarial effects of
clindamycin in man. Am J Trop Med Hyg.1975; 24:369
-370.
PUBMED
56. Colwell EJ, Hickman RL, Kosakal S. Quinine-tetracycline and
quinine-bactrim treatment of acute falciparum malaria in Thailand.
Ann Trop Med Parasitol.1973; 67:125
-132.
PUBMED
57. Colwell EJ, Hickman RL, Kosakal S. Tetracycline treatment of
chloroquine-resistant falciparum malaria in Thailand.
JAMA. 1972;220:684
-686.
FREE FULL TEXT
58. Hall AP, Doberstyn EB, Nanokorn A, Sonkom P. Falciparum malaria
semi-resistant to clindamycin. Br Med J.1975; 2:12
-14.
PUBMED
59. Karbwang J, Molunto P, Bunnag D, Harinasuta T. Plasma quinine
levels in patients with falciparum malaria when given alone or in combination
with tetracycline with or without primaquine. Southeast Asian J
Trop Med Public Health.1991; 22:72
-76.
PUBMED
60. Karbwang J, Na-Bangchang K, Thanavibul A, Bunnag D,
Chongsuphajaisiddhi T, Harinasuta T. Comparison of oral artesunate and quinine
plus tetracycline in acute uncomplicated falciparum malaria. Bull
World Health Organ. 1994;72:233
-238.
PUBMED
61. Kremsner PG, Winkler S, Brandts C, Neifer S, Bienzle U, Graninger
W. Clindamycin in combination with chloroquine or quinine is an effective
therapy for uncomplicated Plasmodium falciparum malaria in children from
Gabon. J Infect Dis.1994; 169:467
-470.
FREE FULL TEXT
62. Kremsner PG, Zotter GM, Feldmeier H, Graninger W, Rocha RM,
Wiedermann G. A comparative trial of three regimens for treating uncomplicated
falciparum malaria in Acre, Brazil. J Infect Dis.1988; 158:1368
-1371.
FREE FULL TEXT
63. Looareesuwan S, Vanijanonta S, Viravan C, et al. Randomised trial
of mefloquine-tetracycline and quinine-tetracycline for acute uncomplicated
falciparum malaria. Acta Trop.1994; 57:47
-53.
PUBMED
64. Looareesuwan S, Wilairatana P, Vanijanonta S, Kyle D, Webster K.
Efficacy of quinine-tetracycline for acute uncomplicated falciparum malaria in
Thailand. Lancet.1992; 339:369
.
PUBMED
65. McGready R, Cho T, Samuel, et al. Randomized comparison of
quinine-clindamycin versus artesunate in the treatment of falciparum malaria
in pregnancy. Trans R Soc Trop Med Hyg.2001; 95:651
-656.
PUBMED
66. Metzger W, Mordmuller B, Graninger W, Bienzle U, Kremsner PG. High
efficacy of short-term quinine-antibiotic combinations for treating adult
malaria patients in an area in which malaria is hyperendemic.
Antimicrob Agents Chemother. 1995;39
: 245-246.
FREE FULL TEXT
67. Miller LH, Glew RH, Wyler DJ, et al. Evaluation of clindamycin in
combination with quinine against multidrug-resistant strains of Plasmodium
falciparum. Am J Trop Med Hyg.1974; 23:565
-569.
FREE FULL TEXT
68. Parola P, Ranque S, Badiaga S, et al. Controlled trial of 3-day
quinine-clindamycin treatment versus 7-day quinine treatment for adult
travelers with uncomplicated falciparum malaria imported from the tropics.
Antimicrob Agents Chemother.2001; 45:932
-935.
FREE FULL TEXT
69. Pukrittayakamee S, Chantra A, Vanijanonta S, Clemens R,
Looareesuwan S, White NJ. Therapeutic responses to quinine and clindamycin in
multidrug-resistant falciparum malaria. Antimicrob Agents
Chemother. 2000;44:2395
-2398.
FREE FULL TEXT
70. Pukrittayakamee S, Chotivanich K, Chantra A, Clemens R,
Looareesuwan S, White NJ. Activities of artesunate and primaquine against
asexual- and sexual-stage parasites in falciparum malaria.
Antimicrob Agents Chemother.2004; 48:1329
-1334.
FREE FULL TEXT
71. Reacher M, Campbell CC, Freeman J, Doberstyn EB, Brandling-Bennett
AD. Drug therapy for Plasmodium falciparum malaria resistant to
pyrimethamine-sulfadoxine (Fansidar): a study of alternate regimens in Eastern
Thailand, 1980. Lancet.1981; 2:1066
-1069.
PUBMED
72. Vaillant M, Millet P, Luty A, et al. Therapeutic efficacy of
clindamycin in combination with quinine for treating uncomplicated malaria in
a village dispensary in Gabon. Trop Med Int Health.1997; 2:917
-919.
PUBMED
73. Vanijanonta S, Chantra A, Phophak N, Chindanond D, Clemens R,
Pukrittayakamee S. Therapeutic effects of chloroquine in combination with
quinine in uncomplicated falciparum malaria. Ann Trop Med
Parasitol. 1996;90:269
-275.
PUBMED
74. Andersen SL, Oloo AJ, Gordon DM, et al. Successful double-blinded,
randomized, placebo-controlled field trial of azithromycin and doxycycline as
prophylaxis for malaria in western Kenya. Clin Infect
Dis. 1998;26:146
-150.
FREE FULL TEXT
75. Baudon D, Martet G, Pascal B, Bernard J, Keundjian A, Laroche R.
Efficacy of daily antimalarial chemoprophylaxis in tropical Africa using
either doxycycline or chloroquine-proguanil: a study conducted in 1996 in the
French Army. Trans R Soc Trop Med Hyg.1999; 93:302
-303.
PUBMED
76. Karwacki JJ, Shanks GD, Kummalue T, Watanasook C. Primaquine
induced hemolysis in a Thai soldier. Southeast Asian J Trop Med
Public Health. 1989;20:555
-556.
PUBMED
77. Ohrt C, Richie TL, Widjaja H, et al. Mefloquine compared with
doxycycline for the prophylaxis of malaria in Indonesian soldiers: a
randomized, double-blind, placebo-controlled trial. Ann Intern
Med. 1997; 126:963
-972.
FREE FULL TEXT
78. Pang L, Limsomwong N, Singharaj P. Prophylactic treatment of vivax
and falciparum malaria with low-dose doxycycline. J Infect
Dis. 1988;158:1124
-1127.
FREE FULL TEXT
79. Pang LW, Limsomwong N, Boudreau EF, Singharaj P. Doxycycline
prophylaxis for falciparum malaria. Lancet.1987; 1:1161
-1164.
PUBMED
80. Rieckmann KH, Yeo AE, Davis DR, Hutton DC, Wheatley PF, Simpson R.
Recent military experience with malaria chemoprophylaxis. Med J
Aust. 1993;158:446
-449.
PUBMED
81. Sanchez JL, DeFraites RF, Sharp TW, Hanson RK. Mefloquine or
doxycycline prophylaxis in US troops in Somalia.
Lancet. 1993;341:1021
-1022.
PUBMED
82. Shamiss A, Atar E, Zohar L, Cain Y. Mefloquine versus doxycycline
for malaria prophylaxis in intermittent exposure of Israeli Air Force aircrew
in Rwanda. Aviat Space Environ Med.1996; 67:872
-873.
PUBMED
83. Shanks GD, Barnett A, Edstein MD, Rieckmann KH. Effectiveness of
doxycycline combined with primaquine for malaria prophylaxis. Med J
Aust. 1995; 162:306
-307, 309-310.
PUBMED
84. Shanks GD, Roessler P, Edstein MD, Rieckmann KH. Doxycycline for
malaria prophylaxis in Australian soldiers deployed to United Nations missions
in Somalia and Cambodia. Mil Med.1995; 160:443
-445.
PUBMED
85. Taylor WR, Richie TL, Fryauff DJ, et al. Malaria prophylaxis using
azithromycin: a double-blind, placebo-controlled trial in Irian Jaya,
Indonesia. Clin Infect Dis.1999; 28:74
-81.
FREE FULL TEXT
86. Adehossi E, Parola P, Foucault C, et al. Three-day
quinine-clindamycin treatment of uncomplicated falciparum malaria imported
from the tropics. Antimicrob Agents Chemother.2003; 47:1173
.
FREE FULL TEXT
87. Ramharter M, Oyakhirome S, Klouwenberg PK, et al.
Artesunate-clindamycin versus quinine-clindamycin in the treatment of
Plasmodium falciparum malaria: a randomized controlled trial. Clin
Infect Dis. 2005;40:1777
-1784.
PUBMED
88. Duarte EC, Fontes CJ, Gyorkos TW, Abrahamowicz M. Randomized
controlled trial of artesunate plus tetracycline versus standard treatment
(quinine plus tetracycline) for uncomplicated Plasmodium falciparum malaria in
Brazil. Am J Trop Med Hyg.1996; 54:197
-202.
FREE FULL TEXT
89. Silamut K, Molunto P, Ho M, Davis TM, White NJ. Alpha 1-acid
glycoprotein (orosomucoid) and plasma protein binding of quinine in falciparum
malaria. Br J Clin Pharmacol.1991; 32:311
-315.
PUBMED
90. Winstanley P, Newton C, Watkins W, et al. Towards optimal regimens
of parenteral quinine for young African children with cerebral malaria: the
importance of unbound quinine concentration. Trans R Soc Trop Med
Hyg. 1993;87:201
-206.
PUBMED
91. White NJ. The treatment of malaria. N Engl J
Med. 1996;335:800
-806.
PUBMED
92. Di Perri G, Allegranzi B, Bonora S. Quinine-induced blindness
reversed by an increase in alpha1-acid glycoprotein level. Ann
Intern Med. 2002;136:339
.
FREE FULL TEXT
93. Severe falciparum malaria: World Health Organization, Communicable
Diseases Cluster. Trans R Soc Trop Med Hyg.2000; 94(suppl 1):S1
-S90.
PUBMED
94. Anabwani G, Canfield CJ, Hutchinson DB. Combination atovaquone and
proguanil hydrochloride vs. halofantrine for treatment of acute Plasmodium
falciparum malaria in children. Pediatr Infect Dis J.1999; 18:456
-461.
PUBMED
95. Blanchard TJ, Mabey DC, Hunt-Cooke A, et al. Multiresistant
falciparum malaria cured using atovaquone and proguanil. Trans R
Soc Trop Med Hyg. 1994; 88:693
.
PUBMED
96. Bouchaud O, Monlun E, Muanza K, et al. Atovaquone plus proguanil
versus halofantrine for the treatment of imported acute uncomplicated
Plasmodium falciparum malaria in non-immune adults: a randomized comparative
trial. Am J Trop Med Hyg.2000; 63:274
-279.
ABSTRACT
97. Bustos DG, Canfield CJ, Canete-Miguel E, Hutchinson DB.
Atovaquone-proguanil compared with chloroquine and
chloroquine-sulfadoxine-pyrimethamine for treatment of acute Plasmodium
falciparum malaria in the Philippines. J Infect Dis.1999; 179:1587
-1590.
FREE FULL TEXT
98. Giao PT, De Vries PJ, Hung LQ, Binh TQ, Nam NV, Kager PA.
Atovaquone-proguanil for recrudescent Plasmodium falciparum in Vietnam.
Ann Trop Med Parasitol.2003; 97:575
-580.
PUBMED
99. Lacy MD, Maguire JD, Barcus MJ, et al. Atovaquone/proguanil therapy
for Plasmodium falciparum and Plasmodium vivax malaria in Indonesians who lack
clinical immunity. Clin Infect Dis.2002; 35:e92
-e95.
FREE FULL TEXT
100. Llanos-Cuentas A, Campos P, Clendenes M, Canfield CJ, Hutchinson
DB. Atovaquone and proguani hydrochloride compared with chloroquine or
pyrimethamine/sulfodaxine for treatment of acute Plasmodium falciparum malaria
in Peru. Braz J Infect Dis.2001; 5:67
-72.
PUBMED
101. Looareesuwan S, Viravan C, Webster HK, Kyle DE, Hutchinson DB,
Canfield CJ. Clinical studies of atovaquone, alone or in combination with
other antimalarial drugs, for treatment of acute uncomplicated malaria in
Thailand. Am J Trop Med Hyg.1996; 54:62
-66.
FREE FULL TEXT
102. Looareesuwan S, Wilairatana P, Chalermarut K, Rattanapong Y,
Canfield CJ, Hutchinson DB. Efficacy and safety of atovaquone/proguanil
compared with mefloquine for treatment of acute Plasmodium falciparum malaria
in Thailand. Am J Trop Med Hyg.1999; 60:526
-532.
ABSTRACT
103. Malvy D, Djossou F, Vatan R, et al. Experience with the combination
atovaquone-proguanil in the treatment of uncomplicated Plasmodium falciparum
malaria—report of 112 cases [article in French]. Med Trop
(Mars). 2002;62:229
-231.
PUBMED
104. Mulenga M, Sukwa TY, Canfield CJ, Hutchinson DB. Atovaquone and
proguanil versus pyrimethamine/sulfadoxine for the treatment of acute
falciparum malaria in Zambia. Clin Ther.1999; 21:841
-852.
PUBMED
105. Radloff PD, Philipps J, Nkeyi M, Hutchinson D, Kremsner PG.
Atovaquone and proguanil for Plasmodium falciparum malaria.
Lancet. 1996;347:1511
-1514.
PUBMED
106. Sabchareon A, Attanath P, Phanuaksook P, et al. Efficacy and
pharmacokinetics of atovaquone and proguanil in children with
multidrug-resistant Plasmodium falciparum malaria. Trans R Soc Trop
Med Hyg. 1998;92:201
-206.
PUBMED
107. Thybo S, Gjorup I, Ronn AM, Meyrowitsch D, Bygberg IC.
Atovaquone-proguanil (malarone): an effective treatment for uncomplicated
Plasmodium falciparum malaria in travelers from Denmark. J Travel
Med. 2004;11:220
-223.
PUBMED
108. Uchiyama H, Okamoto A, Sato K, et al. Quinine-resistant severe
falciparum malaria effectively treated with atovaquone and proguanil
hydrochloride combination therapy. Intern Med.2004; 43:624
-627.
PUBMED
109. van Vugt M, Leonardi E, Phaipun L, et al. Treatment of
uncomplicated multidrug-resistant falciparum malaria with
artesunate-atovaquone-proguanil. Clin Infect Dis.2002; 35:1498
-1504.
FREE FULL TEXT
110. David KP, Alifrangis M, Salanti A, Vestergaard LS, Ronn A, Bygbjerg
IB. Atovaquone/proguanil resistance in Africa: a case report. Scand
J Infect Dis. 2003;35:897
-898.
PUBMED
111. Farnert A, Lindberg J, Gil P, et al. Evidence of Plasmodium
falciparum malaria resistant to atovaquone and proguanil hydrochloride: case
reports. BMJ.2003; 326:628
-629.
FREE FULL TEXT
112. Fivelman QL, Butcher GA, Adagu IS, Warhurst DC, Pasvol G. Malarone
treatment failure and in vitro confirmation of resistance of Plasmodium
falciparum isolate from Lagos, Nigeria. Malar J.2002; 1:1
.
PUBMED
113. Schwartz E, Bujanover S, Kain KC. Genetic confirmation of
atovaquone-proguanil-resistant Plasmodium falciparum malaria acquired by a
nonimmune traveler to East Africa. Clin Infect Dis.2003; 37:450
-451.
FREE FULL TEXT
114. Wichmann O, Muehlen M, Gruss H, Mockenhaupt FP, Suttorp N, Jelinek
T. Malarone treatment failure not associated with previously described
mutations in the cytochrome b gene. Malar J.2004; 3:14
.
PUBMED
115. Kuhn S, Gill MJ, Kain KC. Emergence of atovaquone-proguanil
resistance during treatment of Plasmodium falciparum malaria acquired by a
non-immune north American traveller to west Africa. Am J Trop Med
Hyg. 2005;72:407
-409.
FREE FULL TEXT
116. Schwobel B, Alifrangis M, Salanti A, Jelinek T. Different mutation
patterns of atovaquone resistance to Plasmodium falciparum in vitro and in
vivo: rapid detection of codon 268 polymorphisms in the cytochrome b as
potential in vivo resistance marker. Malar J.2003; 2:5
.
PUBMED
117. Boggild AK, Parise ME, et al. Atovaquone-proguanil: report from a
CDC expert meeting on malaria chemoprophylaxis (II). Am J Trop Med
Hyg. 2007: 208-22376
.
FREE FULL TEXT
118. Health Information for International Travel
2007-2008. Atlanta, Ga: Elsevier; 2007.119. Product information: Larium brand of mefloquine
hydrochloride tablets. Bas, Switzerland: Hoffman-La Roche;2002
.120. Hall AP, Doberstyn EB, Karnchanachetanee C, et al. Sequential
treatment with quinine and mefloquine or quinine and pyrimethamine-sulfadoxine
for falciparum malaria. Br Med J.1977; 1:1626
-1628.
FREE FULL TEXT
121. Baird JK, Sustriayu Nalim MF, Basri H, et al. Survey of resistance
to chloroquine by Plasmodium vivax in Indonesia. Trans R Soc Trop
Med Hyg. 1996;90:409
-411.
PUBMED
122. Baird JK, Wiady I, Fryauff DJ, et al. In vivo resistance to
chloroquine by Plasmodium vivax and Plasmodium falciparum at Nabire, Irian
Jaya, Indonesia. Am J Trop Med Hyg.1997; 56:627
-631.
FREE FULL TEXT
123. Fryauff DJ, Tuti S, Mardi A, et al. Chloroquine-resistant
Plasmodium vivax in transmigration settlements of West Kalimantan, Indonesia.
Am J Trop Med Hyg.1998; 59:513
-518.
ABSTRACT
124. Murphy GS, Basri H, Purnomo HB, et al. Vivax malaria resistant to
treatment and prophylaxis with chloroquine. Lancet.1993; 341:96
-100.
PUBMED
125. Rieckmann KH, Davis DR, Hutton DC. Plasmodium vivax resistance to
chloroquine? Lancet.1989; 2:1183
-1184.
PUBMED
126. Schuurkamp GJ, Spicer PE, Kereu RK, Bulungol PK, Rieckmann KH.
Chloroquine-resistant Plasmodium vivax in Papua New Guinea. Trans R
Soc Trop Med Hyg. 1992;86:121
-122.
PUBMED
127. Sumawinata IW, Subianto B, Leksana B, et al. Very high risk of
therapeutic failure with chloroquine for uncomplicated Plasmodium falciparum
and P. vivax malaria in Indonesian Papua. Am J Trop Med
Hyg. 2003;68:416
-420.
FREE FULL TEXT
128. Whitby M, Wood G, Veenendaal JR, Rieckmann K. Chloroquine-resistant
Plasmodium vivax. Lancet.1989; 2:1395
.
PUBMED
129. Alcantara AK, Uylangco CV, Sangalang RP, Cross JH. A comparative
clinical study of mefloquine and chloroquine in the treatment of vivax
malaria. Southeast Asian J Trop Med Public Health.1985; 16:534
-538.
PUBMED
130. Collignon P. Chloroquine resistance in Plasmodium vivax.
J Infect Dis.1991; 164:222
-223.
FREE FULL TEXT
131. Dixon KE, Pitaktong U, Phintuyothin P. A clinical trial of
mefloquine in the treatment of Plasmodium vivax malaria. Am J Trop
Med Hyg. 1985;34:435
-437.
FREE FULL TEXT
132. Hanna J. Chloroquine-resistant Plasmodium vivax: how common?
Med J Aust.1993; 158:502
-503.
PUBMED
133. Harinasuta T, Bunnag D, Lasserre R, Leimer R, Vinijanont S. Trials
of mefloquine in vivax and of mefloquine plus "fansidar" in
falciparum malaria. Lancet.1985; 1:885
-888.
PUBMED
134. Pukrittayakamee S, Chantra A, Simpson JA, et al. Therapeutic
responses to different antimalarial drugs in vivax malaria.
Antimicrob Agents Chemother.2000; 44:1680
-1685.
FREE FULL TEXT
135. Schwartz IK, Lackritz EM, Patchen LC. Chloroquine-resistant
Plasmodium vivax from Indonesia. N Engl J Med.1991; 324:927
.
PUBMED
136. Maguire JD, Krisin, Marwoto H, Richie TL, Fryauff DJ, Baird JK.
Mefloquine is highly efficacious against chloroquine-resistant Plasmodium
vivax malaria and Plasmodium falciparum malaria in Papua, Indonesia.
Clin Infect Dis.2006; 42:1067
-1072.
FREE FULL TEXT
137. Looareesuwan S, Wilairatana P, Glanarongran R, et al. Atovaquone
and proguanil hydrochloride followed by primaquine for treatment of Plasmodium
vivax malaria in Thailand. Trans R Soc Trop Med Hyg.1999; 93:637
-640.
PUBMED
138. Baird JK, Basri H, Subianto B, et al. Treatment of
chloroquine-resistant Plasmodium vivax with chloroquine and primaquine or
halofantrine. J Infect Dis.1995; 171:1678
-1682.
FREE FULL TEXT
139. Glucose-6-phosphate dehydrogenase deficiency. Bull World
Health Organ. 1989;67:601
-611.
PUBMED
140. Hill DR, Baird JK, Parise ME, Lewis LS, Ryan ET, Magill AJ.
Primaquine: report from CDC expert meeting on malaria chemoprophylaxis I.
Am J Trop Med Hyg.2006; 75:402
-415.
FREE FULL TEXT
141. Povinelli L, Monson TA, Fox BC, Parise ME, Morrisey JM, Vaidya AB.
Plasmodium vivax malaria in spite of atovaquone/proguanil (malarone)
prophylaxis. J Travel Med.2003; 10:353
-355.
PUBMED
142. Jimenez BC, Navarro M, Huerga H, Lopez-Roman E, Mendoza A,
Lopez-Velez R. Tertian malaria (Plasmodium vivax and Plasmodium ovale) in two
travelers despite atovaquone-proguanil prophylaxis. J Travel
Med. 2006;13:373
-375.
PUBMED
143. Alving AS, Johnson CF, Tarlov AR, Brewer GJ, Kellermeyer RW, Carson
PE. Mitigation of the haemolytic effect of primaquine and enhancement of its
action against exoerythrocytic forms of the Chesson strain of Plasmodium vivax
by intermittent regimens of drug administration: a preliminary report.
Bull World Health Organ.1960; 22:621
-631.
PUBMED
144. Myat-Phone K, Myint O, Myint L, Thaw Z, Kyin Hla A, Nwe Nwe Y.
Emergence of chloroquineresistant Plasmodium vivax in Myanmar (Burma).
Trans R Soc Trop Med Hyg.1993; 87:687
.
PUBMED
145. Miller KD, Greenberg AE, Campbell CC. Treatment of severe malaria
in the United States with a continuous infusion of quinidine gluconate and
exchange transfusion. N Engl J Med.1989; 321:65
-70.
PUBMED
146. Phillips RE, Warrell DA, White NJ, Looareesuwan S, Karbwang J.
Intravenous quinidine for the treatment of severe falciparum malaria: clinical
and pharmacokinetic studies. N Engl J Med.1985; 312:1273
-1278.
PUBMED
147. van Hensbroek MB, Onyiorah E, Jaffar S, et al. A trial of
artemether or quinine in children with cerebral malaria. N Engl J
Med. 1996;335:69
-75.
PUBMED
148. Newton PN, Angus BJ, Chierakul W, et al. Randomized comparison of
artesunate and quinine in the treatment of severe falciparum malaria.
Clin Infect Dis.2003; 37:7
-16.
FREE FULL TEXT
149. Molyneux ME, Taylor TE, Thomas CG, Mansor S, Wirima JJ. Efficacy of
quinine for falciparum malaria according to previous chloroquine exposure.
Lancet. 1991;337:1379
-1380.
PUBMED
150. Zucker JR, Campbell CC. Malaria: principles of prevention and
treatment. Infect Dis Clin North Am.1993; 7:547
-567.
PUBMED
151. White NJ, Looareesuwan S, Warrell DA, Chong-suphajaisiddhi T,
Bunnag D, Harinasuta T. Quinidine in falciparum malaria.
Lancet. 1981;2:1069
-1071.
PUBMED
152. Availability and use of parenteral quinidine gluconate for severe
or complicated malaria. MMWR Morb Mortal Wkly Rep.2000; 49:1138
-1140.
PUBMED
153. Humar A, Sharma S, Zoutman D, Kain KC. Fatal falciparum malaria in
Canadian travellers. CMAJ.1997; 156:1165
-1167.
FREE FULL TEXT
154. Rosenthal PJ, Peterson C, Geertsma FR, Kohl S. Availability of
intravenous quinidine for falciparum malaria. N Engl J
Med. 1996;335:138
.
PUBMED
155. Murphy S, English M, Waruiru C, et al. An open randomized trial of
artemether versus quinine in the treatment of cerebral malaria in African
children. Trans R Soc Trop Med Hyg.1996; 90:298
-301.
PUBMED
156. Warrell DA, Looareesuwan S, Warrell MJ, et al. Dexamethasone proves
deleterious in cerebral malaria: a double-blind trial in 100 comatose
patients. N Engl J Med.1982; 306:313
-319.
PUBMED
157. White NJ, Warrell DA. Managing cerebral malaria. Br Med
J (Clin Res Ed). 1982;285:439
-440.
158. Dondorp A, Nosten F, Stepniewska K, Day N, White N. Artesunate
versus quinine for treatment of severe falciparum malaria: a randomised trial.
Lancet. 2005;366:717
-725.
PUBMED
159. Hoontrakoon S, Suputtamongkol Y. Exchange transfusion as an adjunct
to the treatment of severe falciparum malaria. Trop Med Int
Health. 1998;3:156
-161.
PUBMED
160. Looareesuwan S, Phillips RE, Karbwang J, White NJ, Flegg PJ,
Warrell DA. Plasmodium falciparum hyperparasitaemia: use of exchange
transfusion in seven patients and a review of the literature. Q J
Med. 1990; 75:471
-481.
FREE FULL TEXT
161. Burchard GD, Kroger J, Knobloch J, et al. Exchange blood
transfusion in severe falciparum malaria: retrospective evaluation of 61
patients treated with, compared to 63 patients treated without, exchange
transfusion. Trop Med Int Health.1997; 2:733
-740.
PUBMED
162. Powell VI, Grima K. Exchange transfusion for malaria and Babesia
infection. Transfus Med Rev.2002; 16:239
-250.
PUBMED
163. Pasvol G, Jacobs M. What is the future of exchange transfusion for
falciparum malaria? J Infect.1999; 39:183
-184.
PUBMED
164. Riddle MS, Jackson JL, Sanders JW, Blazes DL. Exchange transfusion
as an adjunct therapy in severe Plasmodium falciparum malaria: a
meta-analysis. Clin Infect Dis.2002; 34:1192
-1198.
FREE FULL TEXT
165. Crawley J, Waruiru C, Mithwani S, et al. Effect of phenobarbital on
seizure frequency and mortality in childhood cerebral malaria: a randomised,
controlled intervention study. Lancet.2000; 355:701
-706.
PUBMED
166. Kochar D, Kumawat B, Bajiya HN, Chauhan S, Kochar SK, Agarwal RP.
Prophylactic role of single dose phenobarbitone in preventing convulsions in
cerebral malaria. J Assoc Physicians India.1997; 45:123
-124.
167. White NJ, Looareesuwan S, Phillips RE, Chanthavanich P, Warrell DA.
Single dose phenobarbitone prevents convulsions in cerebral malaria.
Lancet. 1988;2:64
-66.
PUBMED
168. Hoffman SL, Rustama D, Punjabi NH, et al. High-dose dexamethasone
in quinine-treated patients with cerebral malaria: a double-blind,
placebo-controlled trial. J Infect Dis.1988; 158:325
-331.
FREE FULL TEXT
169. Prasad K, Garner P. Steroids for treating cerebral malaria.
Cochrane Database Syst Rev.2000; (2):CD000972
.170. Borochovitz D, Crosley AL, Metz J. Disseminated intravascular
coagulation with fatal haemorrhage in cerebral malaria. Br Med
J. 1970;2:710
.
FREE FULL TEXT
171. Hemmer CJ. Neither heparin nor acetylsalicylic acid influence the
clinical course in human Plasmodium falciparum malaria: a prospective
randomized study. Am J Trop Med Hyg.1991; 45:608
-612.
FREE FULL TEXT
172. Munir M, Tjandra H, Rampengan TH, Mustadjab I, Wulur FH. Heparin in
the treatment of cerebral malaria. Paediatr Indones.1980; 20:47
-50.
PUBMED
173. Punyagupta S, Srichaikul T, Akarawong K. The use of heparin in
fatal pulmonary edema due to acute falciparum malaria. J Med Assoc
Thai. 1972;55:121
-131.
PUBMED
174. Punyagupta S, Srichaikul T, Nitiyanant P, Petchclai B. Acute
pulmonary insufficiency in falciparum malaria: summary of 12 cases with
evidence of disseminated intravascular coagulation. Am J Trop Med
Hyg. 1974;23:551
-559.
FREE FULL TEXT
175. Rampengan TH. Cerebral malaria in children: comparative study
between heparin, dexamethasone and placebo. Paediatr
Indones. 1991;31:59
-66.
PUBMED
176. Reid HA. Letter: Adjuvant treatment of severe falciparum malaria,
intravascular coagulation, and heparin. Lancet.1975; 1:167
-168.
PUBMED
177. Thuma PE, Mabeza GF, Biemba G, et al. Effect of iron chelation
therapy on mortality in Zambian children with cerebral malaria.
Trans R Soc Trop Med Hyg.1998; 92:214
-218.
PUBMED
178. Thuma PE, Olivieri NF, Mabeza GF, et al. Assessment of the effect
of the oral iron chelator deferiprone on asymptomatic Plasmodium falciparum
parasitemia in humans. Am J Trop Med Hyg.1998; 58:358
-364.
ABSTRACT
179. Looareesuwan S, Wilairatana P, Vannaphan S, et al. Pentoxifylline
as an ancillary treatment for severe falciparum malaria in Thailand.
Am J Trop Med Hyg.1998; 58:348
-353.
ABSTRACT
180. Agbenyega T, Planche T, Bedu-Addo G, et al. Population kinetics,
efficacy, and safety of dichloroacetate for lactic acidosis due to severe
malaria in children. J Clin Pharmacol.2003; 43:386
-396.
FREE FULL TEXT
181. Parise M, Lewis LS. Severe malaria: North American perspective. In:
Feldman CSG, ed. Tropical and Parasitic Infections in the
ICU. New York, NY: Springer Science Business Media Inc;2005
: 17-37.182. Phillips RE, Looareesuwan S, White NJ, et al. Hypoglycaemia and
antimalarial drugs: quinidine and release of insulin. Br Med J
(Clin Res Ed). 1986;292:1319
-1321.
PUBMED
183. White NJ, Warrell DA, Chanthavanich P, et al. Severe hypoglycemia
and hyperinsulinemia in falciparum malaria. N Engl J
Med. 1983;309:61
-66.
PUBMED
184. White N. Controversies in the management of severe falciparum
malaria. In: Pasvol G, ed. Balliere's Clinical Infectious Diseases:
Malaria [Volume 2]. London, England: Baillière Tindall;1995
: 309-330.185. Butler T, Tong MJ, Fletcher JR, Dostalek RJ, Robbins TO. Blood
coagulation studies in Plasmodium falciparum malaria. Am J Med
Sci. 1973;265:63
-67.
PUBMED
186. Phillips RE, Looareesuwan S, Warrell DA, et al. The importance of
anaemia in cerebral and uncomplicated falciparum malaria: role of
complications, dyserythropoiesis and iron sequestration. Q J
Med. 1986; 58:305
-323.
FREE FULL TEXT
187. Marino P. The ICU Book. 2nd ed. Baltimore,
Md: Williams & Wilkins; 1998.188. Davis TM, Pukrittayakamee S, Woodhead JS, Holloway P, Chaivisuth B,
White NJ. Calcium and phosphate metabolism in acute falciparum malaria.
Clin Sci (Lond).1991; 81:297
-304.
PUBMED
189. Newton CR, Hien TT, White N. Cerebral malaria. J Neurol
Neurosurg Psychiatry.2000; 69:433
-441.
FREE FULL TEXT
190. U.D.E. Group, ed. USP DI Drug Information for the
Healthcare Provider. 23rd ed. Taunton, Mass: Micromedex Inc;2003
.191. Conchie JM, Munroe JD, Anderson DO. The incidence of staining of
permanent teeth by the tetracyclines. Can Med Assoc J.1970; 203:351
-356.
PUBMED
192. Dubos F, Delattre P, Demar M, Carme B, Gendrel D. Safety of
mefloquine in infants with acute falciparum malaria. Pediatr Infect
Dis J. 2004;23:679
-681.
PUBMED
193. Luxemburger C, Price RN, Nosten F, Ter Kuile FO,
Chongsuphajaisiddhi T, White NJ. Mefloquine in infants and young children.
Ann Trop Paediatr.1996; 16:281
-286.
PUBMED
194. Sowunmi A, Oduola AM. Open comparison of mefloquine,
mefloquine/sulfadoxine/pyrimethamine and chloroquine in acute uncomplicated
falciparum malaria in children. Trans R Soc Trop Med
Hyg. 1995;89:303
-305.
PUBMED
195. ter Kuile FO, Nosten F, Luxemburger C, et al. Mefloquine treatment
of acute falciparum malaria: a prospective study of non-serious adverse
effects in 3673 patients. Bull World Health Organ.1995; 73:631
-642.
PUBMED
196. ter Kuile FO, Nosten F, Thieren M, et al. High-dose mefloquine in
the treatment of multidrug-resistant falciparum malaria. J Infect
Dis. 1992;166:1393
-1400.
FREE FULL TEXT
197. Canadian recommendations for the prevention and treatment of
malaria among international travellers. Committee to Advise on Tropical
Medicine and Travel CATMAT), Laboratory for Disease Control. Can
Commun Dis Rep.2000; 26(suppl 2):i
-vi, 1-42.
198. Looareesuwan S, Phillips RE, White NJ, et al. Quinine and severe
falciparum malaria in late pregnancy. Lancet.1985; 2:4
-8.
PUBMED
199. McGready R, Keo NK, Villegas L, White NJ, Looareesuwan S, Nosten F.
Artesunate-atovaquone-proguanil rescue treatment of multidrug-resistant
Plasmodium falciparum malaria in pregnancy: a preliminary report.
Trans R Soc Trop Med Hyg.2003; 97:592
-594.
PUBMED
200. McGready R, Stepniewska K, Edstein MD, et al. The pharmacokinetics
of atovaquone and proguanil in pregnant women with acute falciparum malaria.
Eur J Clin Pharmacol.2003; 59:545
-552.
PUBMED
201. Nosten F, Vincenti M, Simpson J, et al. The effects of mefloquine
treatment in pregnancy. Clin Infect Dis.1999; 28:808
-815.
FREE FULL TEXT
202. Nosten F, Karbwang J, White NJ, et al. Mefloquine antimalarial
prophylaxis in pregnancy: dose finding and pharmacokinetic study.
Br J Clin Pharmacol.1990; 30:79
-85.
PUBMED
203. Nosten F, ter Kuile F, Maelankiri L, et al. Mefloquine prophylaxis
prevents malaria during pregnancy: a double-blind, placebo-controlled study.
J Infect Dis.1994; 169:595
-603.
FREE FULL TEXT
204. Phillips-Howard PA, Steffen R, Kerr L, et al. Safety of mefloquine
and other antimalarial agents in the first trimester of pregnancy.
J Travel Med.1998; 5:121
-126.
PUBMED
205. Steketee RW, Wirima JJ, Slutsker L, Khoromana CO, Heymann DL,
Breman JG. Malaria treatment and prevention in pregnancy: indications for use
and adverse events associated with use of chloroquine or mefloquine.
Am J Trop Med Hyg.1996; 55 (suppl):50
-56.
PUBMED
206. Vanhauwere B, Maradit H, Kerr L. Post-marketing surveillance of
prophylactic mefloquine (Lariam) use in pregnancy. Am J Trop Med
Hyg. 1998;58:17
-21.
ABSTRACT
207. Lackritz EM, Lobel HO, Howell BJ, Bloland P, Campbell CC. Imported
Plasmodium falciparum malaria in American travelers to Africa: implications
for prevention strategies. JAMA.1991; 265:383
-385.
FREE FULL TEXT
208. Lobel HO, Campbell CC, Schwartz IK, Roberts JM. Recent trends in
the importation of malaria caused by Plasmodium falciparum into the United
States from Africa. J Infect Dis.1985; 152:613
-617.
FREE FULL TEXT
209. Nahlen BL, Lobel HO, Cannon SE, Campbell CC. Reassessment of blood
donor selection criteria for United States travelers to malarious areas.
Transfusion.1991; 31:798
-804.
PUBMED
|