 |
 |

JAMA-EXPRESS
Efficacité et tolérance du pyridoxal 5'-phosphate (MC-1) chez les patients à haut risque subissant un pontage coronaireL’essai clinique randomisé MEND-CABG II
Les investigaeurs MEND-CABG II
JAMA. 2008;299(15):1777-1787
RÉSUMÉ
 |  |
Contexte La chirurgie des pontages coronaires (CABG) est fréquemment réalisée et reste efficace ; cependant, les complications péri-opératoires liées aux lésions d'ischémie-reperfusion, y compris l'infarctus du myocarde (MI), demeurent communes et résultent en une morbidité et mortalité significatives. MC-1, un métabolite naturel de la pyridoxine et un antagoniste des récepteurs purinergiques, empêche la surcharge cellulaire en calcium et peut réduire les dommages d'ischémie-reperfusion.
Objectif Evaluer l'efficacité et la tolérance de MC-1 administré juste avant et pendant 30 jours après la chirurgie chez les patients subissant un CABG.
Schéma, environnement et participants Essai MC-1 to Eliminate Necrosis and Damage in Coronary Artery Bypass Graft Surgery II Trial II, essai de phase III, multicentrique, randomisé, en double insu, contre placebo, sur 3023 patients à risque intermédiaire et élevé, subissant un CABG avec bypass cardio-pulmonaire inclus entre octobre 2006 et septembre 2007 dans 130 centres au Canada, Etats-Unis, et Allemagne.
Interventions Les patients recevaient du MC-1, 250 mg/j (n=1519), ou un placebo apparié (n=1504) juste avant et pendant 30 jours après chirurgie de CABG.
Principaux critères de jugement Les critères primaires d'efficacité étaient le décès cardio-vasculaire ou IDM non mortel, défini comme une fraction MB de la créatine kinase (CK) d’au moins 100 ng/ml ou de nouvelles ondes Q au 30ème jour postopératoire.
Résultats Les critères primaires d'efficacité sont apparus chez 140 patients sur 1510 (9.3%) dans le groupe MC-1 et 133 sur 1486 (9.0%) dans le groupe placebo (rapport de risque, 1.04 ; intervalle de confiance à 95%, 0.83-1.30 ; P=0.76). La mortalité toutes causes a été plus élevée chez les patients du groupe MC-1 par rapport au placebo à 4 jours (1.0% contre 0.3% ; P=0.03) mais était semblable au 30ème jour (1.9% contre 1.5% ; P=0.44). Il n'y a eu aucune différence pour l’aire sous la courbe de la CK-MB entre 8 et 24 heures entre les groupes MC-1 et placebo (médiane, 270 [extrêmes interquartiles, 175-492] contre 268 [extrêmes interquartiles, 170-456] heures x ng/ml ; P=0.11).
Conclusion Dans cette population de patients à risque intermédiaire à élevé subissant un pontage coronaire, le MC-1 n'a pas réduit le critère composé comprenant les décès d’origine cardio-vasculaires ou les IDM non mortels.
Trial Registration clinicaltrials.gov Identifier: NCT00402506
Les pontages de l'artère coronaire (cabg) sont l'une des options thérapeutiques majeures pour améliorer l’angor, la survie et la qualité de vie des patients ayant une maladie coronarienne multitronculaire.1 Il s’agit de la procédure chirurgicale cardiaque la plus fréquemment réalisée dans le monde, et en 2005, plus de 250 000 procédures de CABG ont été exécutées aux Etats-Unis.2 Tandis que la mortalité opératoire diminuait avec le temps, des complications sévères comme l'infarctus du myocarde (IDM), l'angor récurrent, l’insuffisance ventriculaire, les arythmies graves, l'insuffisance rénale, les accidents vasculaires cérébraux, et les décès continuent de limiter la revascularisation chirurgicale, en particulier chez les patients à haut risque, qui représentent une proportion croissante de ceux référés pour chirurgie. 3-8 Plusieurs de ces complications sont au moins partiellement attribuables au processus de lésion par ischémie-reperfusion. 9 Si les résultats chez les patients ayant un pontage coronaire doivent être améliorés, le développement de meilleures stratégies pour réduire les lésions d’ischémie-reperfusion sont impératives.
MC-1 (Medicure International Inc, Winnipeg, Manitoba, Canada) contient du monohydrate de pyridoxal 5’-phosphate, un métabolite naturel de la pyridoxine (vitamine B6). MC-1, un antagoniste des récepteurs purinergiques (P2), empêche la surcharge cellulaire en calcium dans les essais précliniques et cliniques sur les lésions d'ischémie-reperfusion.10-13 Dans le MC-1 to Eliminate Necrosis and Damage in Coronary Artery Bypass Graft Surgery Trial (MEND-CABG), une étude de phase II, randomisée, multicentrique, contre placebo et en double insu chez des patients à haut risque subissant un pontage coronaire (n=901), un traitement avec 250 mg/jour de MC-1 a permis une réduction non significative de 14% des du critère primaire composé comprenant les décès, les IDM (créatine kinase MB ou CK-MB  50ng/ml), ou des AVC (P=0.31).14 Dans une analyse post hoc utilisant des définitions plus rigoureuses d’IDM (CK-MB 50ng/ml), ou des AVC (P=0.31).14 Dans une analyse post hoc utilisant des définitions plus rigoureuses d’IDM (CK-MB  70 ou 70 ou  100 ng/ml), MC-1 a été toutefois associé à des réductions plus importantes statistiquement significatives du critère composé comprenant les décès ou les IDM. 14 100 ng/ml), MC-1 a été toutefois associé à des réductions plus importantes statistiquement significatives du critère composé comprenant les décès ou les IDM. 14
MEND-CABG II a été entreprise pour répliquer les observations positives de MEND-CABG en utilisant une définition plus stricte d’IDM (CK-MB 100 ng/ml). L’objectif primaire de MEND-CABG II était d’évaluer l’effet cardioprotecteur de MC-1, 250 mg/jour, administré avant et continué pendant 30 jours après la chirurgie, par rapport au placebo, sur l’incidence des décès d’origine cardiovasculaire ou des IDM non mortels à 30 jours chez des patients à haut risque subissant un pontage coronaire. Un objectif secondaire était de déterminer la tolérance de MC-1 administré dans le contexte d’un pontage coronaire. 100 ng/ml). L’objectif primaire de MEND-CABG II était d’évaluer l’effet cardioprotecteur de MC-1, 250 mg/jour, administré avant et continué pendant 30 jours après la chirurgie, par rapport au placebo, sur l’incidence des décès d’origine cardiovasculaire ou des IDM non mortels à 30 jours chez des patients à haut risque subissant un pontage coronaire. Un objectif secondaire était de déterminer la tolérance de MC-1 administré dans le contexte d’un pontage coronaire.
METHODES
Schéma de l’étude et organisation de l’essai
Le schéma de MEND-CABG II a été précédemment décrit dans le détail.15 En bref, MEND-CABG II était un essai clinique de phase III, multicentrique, randomisé, en double insu, contre placebo pour évaluer l’effet de MC-1, 250 mg/jour, administré en préopératoire et pendant 30 jours en postopératoire sur les décès cardiovasculaires et l’IDM des patients à haut risque subissant un pontage coronaire. Un comité scientifique universitaire exerçait la direction scientifique et la surveillance de l’étude. Un bureau indépendant de surveillance des données et de tolérance suivait la tolérance des participants de l’essai.
Population des patients
Les patients ont été inclus entre Octobre 2006 et septembre 2007 dans 130 centres au in Canada, Etats-Unis, et Allemagne. Pour être éligibles, les patients devaient avoir au moins 18 ans, une programmation de pontage coronaire avec bypass cardio-pulmonaire, et 2 traits ou plus les plaçant à haut risque de complications cardiovasculaires lors de la chirurgie. Comme dans MEND-CABG, les traits de risque élevés étaient définis par un âge de 65 ans ou plus, un tabagisme actuel ou récent ; un diabète; une dysfonction ventriculaire gauche (fraction d’éjection  45%) ou une insuffisance cardiaque congestive; des antécédents d’AVC, d’accident ischémique transitoire, ou d’endartériectomie carotidienne; le besoin d’un pontage coronaire urgent; des antécédents d’IDM récent ( 45%) ou une insuffisance cardiaque congestive; des antécédents d’AVC, d’accident ischémique transitoire, ou d’endartériectomie carotidienne; le besoin d’un pontage coronaire urgent; des antécédents d’IDM récent (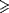 48 heures mais 48 heures mais  6 semaines); une revascularisation antérieure ou une maladie artérielle périphérique; une dysfonction rénale modérée (clairance estimée de la créatinine 6 semaines); une revascularisation antérieure ou une maladie artérielle périphérique; une dysfonction rénale modérée (clairance estimée de la créatinine  30 ml/min mais 30 ml/min mais  60 ml/ min); et une sténose asymptomatique d’au moins 50% au moins dans une artère carotidienne.14 60 ml/ min); et une sténose asymptomatique d’au moins 50% au moins dans une artère carotidienne.14
Les critères d’exclusion incluaient la grossesse; une chirurgie valvulaire programme ou un autre type de chirurgie; l’incapacité de suivre la consultation de dépistage au moins 4 heures avant la chirurgie; un score à l’examen du Mini-Mental State inférieur à 24; un choc cardiogénique; une rupture inter-ventriculaire ou d’un muscle papillaire; un diabète non contrôlé (glycémie  24 mmol/l ou 24 mmol/l ou  432 mg/ dl); un IDM aigu ( 432 mg/ dl); un IDM aigu ( 48 heures); une clairance estimée de la créatine inférieure à 30 ml/ min ou un syndrome néphrotique; des antécédents de maladie maligne au cours des 5 ans passées; un alcoolisme ou une toxicomanie; toute pathologie médicale ou psychiatrique qui, selon l’investigateur, rendait le patient non qualifié pour l’étude; et la participation à une autre étude pharmacologique ou concernant un appareillage durant les 30 jours. 48 heures); une clairance estimée de la créatine inférieure à 30 ml/ min ou un syndrome néphrotique; des antécédents de maladie maligne au cours des 5 ans passées; un alcoolisme ou une toxicomanie; toute pathologie médicale ou psychiatrique qui, selon l’investigateur, rendait le patient non qualifié pour l’étude; et la participation à une autre étude pharmacologique ou concernant un appareillage durant les 30 jours.
L’approbation d’un comité institutionnel de revue ou d’un comité d’éthique a été obtenue dans tous les centres participants et tous les participants ont donné leur consentement éclairé écrit avant l’inclusion.
Randomisation et administration du médicament à l’étude
Les patients étaient sélectionnés avant la randomisation et le pontage coronaire. A l’aide d’un système de réponse vocale automatisée, les patients participants étaient randomisés selon un rapport 1:1 pour recevoir MC-1, 250 mg/jour, ou un placebo identique en aveugle (FIGURE 1). La randomisation était stratifiée selon le centre. La première dose orale du traitement à l’étude était administrée 3 à 10 heures avant le pontage. Si la chirurgie était retardée ou reprogrammée, une deuxième dose préopératoire était administrée pour s’assurer que tous les patients recevaient le médicament à l’étude 3 à 10 heures avant la chirurgie. Durant celle-ci, le protocole demandait l’utilisation d’un bypass cardio-pulmonaire, une hypothermie générale modérée (30°-35°C), et une anti-coagulation systématique.
|
|

|
Figure 1. Randomisation des patients et suivi
Tous les patients randomisés avec suivi pour les critères primaires ont été inclus dans l'analyse primaire indépendamment s’ils avaient reçu le médicament à l’étude ou avaient eu la chirurgie.
|
|
|
La première dose postopératoire du médicament à l'étude a été administrée pendant 24 heures (±8 heures) suivant la dose préopératoire. Les doses suivantes de médicament à l'étude ont été administrées avec les repas commençant 24 heures (±4 heures) après la première dose postopératoire puis ont été continuées une fois par jour jusqu’au 30ème jour postopératoire. Les patients qui ne pouvaient pas avaler au moment de la première dose postopératoire ont eu une dose intraveineuse de MC-1 (5 mg) ou de placebo en aveugle par injection d’un bolus, 24 heures (±8 heures) suivant la dose préopératoire. Cette dose intraveineuse devait permettre atteindre un niveau plasmatique semblable à la dose orale de 250 mg de MC-1. Si le patient pouvait alors avaler, le dosage oral débutait le jour suivant. Si le patient restait incapable d'avaler, le dosage intraveineux était continué une fois par jour pendant un maximum de 4 jours.
Tous les autres soins médicaux étaient laissés à la discrétion du chirurgien cardiaque et des autres médecins traitants. L'utilisation d’un traitement médical basé sur les recommandations et de la modification du style de vie était vivement recommandée.
Recueil des données et suivi
Les informations concernant les patients sur les caractéristiques démographiques, les antécédents médicaux, l'électrocardiographie et les résultats biologiques, les détails des procédures chirurgicales, médicaments concomitants, les événements cliniques, et les événements indésirables sévères et non sévères ont été recueillis pendant 90 jours à l’aide d’un formulaire de rapport de cas normalisé. Les données sur la race ont été recueillies pour déterminer si MC-1 avait un effet différentiel chez les patients de différentes races. La race était individuellement rapportée par les patients, enregistrée dans le rapport médical du patient, et recueillie dans les catégories suivantes : Blanc, Noir/Afro-américain, Indien nord-américain/Natif de l’Alaska/Inuit, Hispanique/Latino, Asiatique/Sud-Est Asiatique/Hawaïen/autre insulaire du Pacifique, ou autre.
Les échantillons de sang pour les niveaux de la CK-MB ont été systématiquement recueillis à la ligne de base et à 8, 12, 16, 24, 36, 48, 72, et 96 heures et à 30 et 90 jours en postopératoire et envoyés à un laboratoire central (Laboratoire central de CIRION, Laval, Québec, Canada) pour analyse. Un test pour la CK-MB de Beckman Coulter, avec des valeurs normales de 2.88 ng/ml pour les femmes et de 4.94 ng/ml pour les hommes, a été employé. Une électrocardiographie systématique était exécutée à la ligne de base et en postopératoire à 48 et 96 heures et à 30 et 90 jours et envoyée à un laboratoire central d'électrocardiographie (Dynacare Kasper Medical Laboratories, Edmonton, Alberta, Canada).
Un suivi clinique des résultats et des événements indésirables était effectué quotidiennement pendant l'hospitalisation index, à 96 heures, et à 30 (extrêmes, 30-40) et 90 jours (extrêmes, 76-104). Il n’était pas requis de rapporter les événements indésirables non sévères communs pré-spécifiés dans la population postopératoire du pontage coronaire, comme la douleur de l’incision, un œdème léger, une anorexie ou une nausée légère/vomissement, constipation, une insomnie ou une légère anxiété, une hypokaliémie ou une hypocalcémie légère, une anémie légère, des atélectasies légères avec épanchement pleural, de la fièvre légère, une hypotension durant le bypass cardio-pulmonaire, et une hypertension légère.
Critères de jugement
Les résultats primaires d'efficacité étaient l'incidence des décès cardio-vasculaires ou de l’IDM non mortel à partir de la randomisation jusqu’au 30ème jour postopératoire. Les critères secondaires d'efficacité incluaient les décès cardio-vasculaires ou l’IDM non mortel au 4ème jour; les décès toutes causes et cardio-vasculaires aux jours 4, 30, et 90 ; un AVC aux jours 4, 30, et 90 ; une fibrillation auriculaire récente aux jours 4, 30, et 90 ; la durée du séjour en USI et de l'hospitalisation index ; l’aire sous la courbe de la fraction de la CK-MB sur 24 heures. La tolérance du MC-1 était évaluée par le recueil des rapports des événements indésirables sévères et non sévères.
Un comité des événements cliniques indépendants, en aveugle (Institut du Cœur de Montréal, Montréal, Québec, Canada) évaluait tous les IDM suspectés, les AVC, et la cause du décès pour tous les décès, et leur évaluation a été employée dans l'analyse primaire. Le diagnostic d’IDM se basait sur les renseignements cliniques collectés dans les centres et sur la CK-MB et les données électrocardiographiques des laboratoires centraux. Les patients étaient diagnostiqués comme ayant un IDM s'ils avaient un pic de CK-MB d’au moins 100 ng/ml dans n'importe quel échantillon au 4ème jour postopératoire; un pic de CK-MB d’au moins 70 ng/ml sur tout échantillon à 96 heures avec de nouvelles ondes Q de 30 ms dans 2 dérivations contiguës ; un nouveau pic de CK-MB d’au moins 25 ng/ml après 96 heures ; ou de nouvelles ondes Q de 30 ms dans 2 dérivations contiguës qui n'étaient pas présentes à 96 heures. Un AVC était défini comme un nouveau déficit neurologique, focal, non traumatique, durant au moins 24 heures. Tous les décès sans cause non cardio-vasculaire identifiable étaient considérés comme d’origine cardio-vasculaire.
Taille de l’échantillon et analyse statistique
La taille de l'échantillon de l'étude a été basée sur une incidence projetée du critère primaire dans le groupe de placebo entre 14% et 17%, sur la base de l'expérience de MEND-CABG et d'autres essais récents dans des populations semblables.14 Une taille d'échantillon de 1500 patients par groupe avait une puissance d’au moins 80% pour détecter une réduction relative de 25% du critère primaire sous MC-1 comparé au placebo sur la base d’un test du chi-2 bilatéral à un niveau  de 0.05. de 0.05.
Les données démographiques, les caractéristiques à la ligne de base, et les données chirurgicales sont récapitulées par groupe en utilisant des statistiques descriptives. Les variables catégorielles sont exprimées en pourcentages. Les variables continues sont exprimées sous la forme de médianes (extrêmes interquartiles [différence interquartile]). Toutes les analyses statistiques ont été exécutées en utilisant le logiciel SAS, version 8.2 (SAS Institute Inc, Cary, Caroline du Nord).
L'incidence du critère primaire d'efficacité dans le groupe actif de traitement a été comparée à l'incidence du groupe placebo par un test du  2 dans la population en intention de traiter. Une valeur de P<0.05 a été considérée comme significative. Les événements du critère primaire identifiés à la visite des 30 jours (jour 30-40) avec une possibilité raisonnable, évaluée par le comité des événements cliniques, d’être survenus avant le 30ème jour ont été inclus dans l'analyse primaire des critères. 2 dans la population en intention de traiter. Une valeur de P<0.05 a été considérée comme significative. Les événements du critère primaire identifiés à la visite des 30 jours (jour 30-40) avec une possibilité raisonnable, évaluée par le comité des événements cliniques, d’être survenus avant le 30ème jour ont été inclus dans l'analyse primaire des critères.
Les critères secondaires pré-spécifiés incluaient la durée d’hospitalisation index, du séjour en USI, et les décès cardio-vasculaires au jour 90. Une procédure d'essais fermée séquentielle a été employée pour ces critères, avec une valeur de P<0.05 considérée comme significative. Le niveau global d’ dans l’étude a été maintenu à 0.05. La durée de séjour à l'hôpital et en unité de soins intensifs a été analysée par des analyses temps-à-événement. Pour ces analyses, les groupes ont été comparés en utilisant des tests du log rank. Les patients décédés avant leur sortie de l’hôpital étaient assignés à une durée de séjour égale à 1 jour de plus que la durée maximale observée de séjour dans les données. dans l’étude a été maintenu à 0.05. La durée de séjour à l'hôpital et en unité de soins intensifs a été analysée par des analyses temps-à-événement. Pour ces analyses, les groupes ont été comparés en utilisant des tests du log rank. Les patients décédés avant leur sortie de l’hôpital étaient assignés à une durée de séjour égale à 1 jour de plus que la durée maximale observée de séjour dans les données.
Toutes autres analyses ont été exécutées en se basant sur la population en intention de traiter et ont été considérées exploratoires. Les taux des critères secondaires catégoriels ont été comparés entre les 2 groupes utilisant le test du  2 le test mid P de Fisher.16 L’aire sous la courbe de la CK-MB entre 8 et 24 heures a été calculé en utilisant la règle trapézoïdale et comparé à l’aide d’un test t après la transformation logarithmique des données. La clairance estimée de la créatinine a été calculée en utilisant la formule décrite par Cockcroft et Gault17 et comparée entre les groupes avec le test du rank-sum de Wilcoxon. Rétrospectivement, après observation des critères primaires, l'incidence des critères primaires, les décès cardio-vasculaires ou l’IDM non mortel, a été recalculée en utilisant d’autres définitions d’IDM en se basant seulement sur les valeurs maximales de CK-MB d’au moins 100 ng/ml, d’au moins 70 ng/ml, et d’au moins 50 ng/ml entre 8 heures et 30 jours. 2 le test mid P de Fisher.16 L’aire sous la courbe de la CK-MB entre 8 et 24 heures a été calculé en utilisant la règle trapézoïdale et comparé à l’aide d’un test t après la transformation logarithmique des données. La clairance estimée de la créatinine a été calculée en utilisant la formule décrite par Cockcroft et Gault17 et comparée entre les groupes avec le test du rank-sum de Wilcoxon. Rétrospectivement, après observation des critères primaires, l'incidence des critères primaires, les décès cardio-vasculaires ou l’IDM non mortel, a été recalculée en utilisant d’autres définitions d’IDM en se basant seulement sur les valeurs maximales de CK-MB d’au moins 100 ng/ml, d’au moins 70 ng/ml, et d’au moins 50 ng/ml entre 8 heures et 30 jours.
L'effet de MC-1 dans les sous-groupes pré-spécifiés basés sur l'âge, le diabète, l'hypertension, le dysfonctionnement rénal, la région d’inclusion, et l'utilisation du traitement à l’étude par voie intraveineuse ont été également évalués. Les événements indésirables ont été codifiés par terme préféré et par classe d'organe utilisant MedDRA (Medical Dictionary for Regulatory Activities; http://www.meddramsso.com/MSSOWeb/index.htm), version 10.1. Certains événements indésirables étaient pré-spécifiés comme ayant un intérêt particulier, comme les infections et infestations, les médiastinite, pneumonie, le sepsis, l’insuffisance rénale aiguë, et une altération rénale. Le pourcentage de patients présentant des événements indésirables est rapporté par groupe.
RESULTATS
Distribution et caractéristiques initiales des patients
Cet article rapporte les résultats principaux jusqu’au 30ème jour postopératoire. Au 7 mars 2008, les données complètes n’étaient pas disponibles pour les critères au 90ème jour. La distribution des patients dans l’étude est montrée dans la FIGURE 1. Au total, 3023 patients ont été randomisés, 1519 sous MC-1 et 1504 sous placebo. L’évaluation du critère principal, le décès d’origine cardiovasculaire et l’IDM non mortel, a été effectuée chez 2996 patients (99.1%) de ceux randomisés. Le statut vital au jour 30 en postopératoire était connu pour tous les patients sauf 25 (0.8%).
Les caractéristiques à la ligne de base de la population de l’étude sont typiques des patients à risque intermédiaire à élevé subissant un pontage coronaire et reflètent les critères d’inclusion de l’essai (TABLEAU 1). L’âge médian des patients était de 66 ans, la plupart étaient blancs, 46% avaient un diabète, 13% une dysfonction rénale, 29% un IDM récent, 8% des antécédents d’AVC, 24% une insuffisance cardiaque et 36% une diminution de la fonction ventriculaire gauche.
|
|

|
Tableau 1. Caractéristiques à la ligne de base a
|
|
|
Médicament à l’étude, chirurgie et traitements concomitants
Presque tous les patients ont reçu le traitement à l’étude avant la chirurgie, la première dose étant administrée une médiane de 5.1 heures avant la chirurgie (TABLEAU 2). La plupart des patients ont reçu plus de 4 doses du traitement à l’étude par voie orale lors de leur séjour à l’hôpital dans les suites de la chirurgie. Un traitement par voie intraveineuse a été administré à 20% des patients, dont la plupart n’ont reçu qu’une dose par voie intraveineuse. L’observance au traitement à l’étude a été bonne, avec moins de 10% des patients manquant plus de 10 doses postopératoires.
|
|

|
Tableau 2. Administration du médicament à l’étude a
|
|
|
Les détails de la chirurgie sont montrés dans le TABLEAU 3. Plus de 98% des patients randomisés ont eu une chirurgie avec un soutien avec bypass cardiopulmonaire. La durée moyenne du clamp aortique a été d’une heure. La plupart des patients a eu une greffe thoracique interne (90%) et des greffons veineux ont été mis en place avec 3 à 4 anastomoses distales. D’autres greffons artériels ont été utilisés chez 9% des patients.
|
|

|
Tableau 3. Détails chirurgicaux a
|
|
|
Les traitements médicaux concomitants en cours d’hospitalisation et à la sortie sont montrés dans le TABLEAU 4. De l’aprotinine et de l’acide tranexamique ont été administrés à 16% à 22% des patients, respectivement. L’utilisation de traitements basés sur les preuves médicales, dont l’aspirine, les bêtabloquants, les inhibiteurs de l’enzyme de conversion de l’angiotensine, et les statines, a été faite de façon appropriée compte tenu du risque de la population. Presque la moitié des patients a reçu des anti-arythmiques à l’hôpital et plus de 80% de l’insuline.
|
|

|
Tableau 4. Traitement médical concomitant
|
|
|
Critères de l’étude
Le critère primaire d’efficacité, le décès cardiovasculaire ou l’IDM non mortel à 30 jours, a été observé chez 140 patients sur 1510 (9.3%) dans le groupe MC-1 et chez 133 patients sur 1486 patients (9.0%) dans le groupe placebo (rapport de risque, 1.04; intervalle de confiance à 95%, 0.83-1.30; P=0.76). Il n’y a pas eu de différence pour le critère primaire dans les sous-groupes pré-spécifiés sur la base de l’âge, du diabète, de la dysfonction rénale, de la région d’inclusion, ou de l’utilisation du traitement par voie intraveineuse (FIGURE 2).
|
|

|
Figure 2. Incidence du critère primaire, des décès cardiovasculaires ou des IDM non mortels jusqu’à 30 jours, dans les groupes globaux et pré-spécifiés
Les barres d'erreur indiquent les intervalles de confiance à 95% (IC). IV indique intraveineux; IDM, infarctus du myocarde.
|
|
|
La plupart des patients ont eu 9 (21%) ou 10 recueils (68%) d’échantillons sanguins lors des 10 temps d’étude définis par le protocole pour les tests de CK-MB. Le pic médian à 96 heures des CK-MB dans la population globale a été de 22.8 (IQR, 14.7-39.3) ng/ml, sans différence entre les groupes de traitement (médiane, 23.1 [IQR, 14.8–40.7] ng/ml pour le MC-1 vs 22.6 [IQR, 14.4-38.0] ng/ml pour le placebo). Il n’y a pas eu non plus de différence de l’aire sous la courbe pour la CK-MB entre 8 et 24 heures entre les patients du groupe MC-1 et ceux du groupe placebo (médiane, 270 [IQR, 175-492] vs 268 [IQR, 170-456] heures  ng/ml; P=0.11). ng/ml; P=0.11).
Les autres critères pré-spécifiés sont montrés dans le TABLEAU 5. Les patients assignés dans le groupe MC-1 ont eu une mortalité cardiovasculaire et toutes causes plus élevée le 4ème jour que les patients assignés au groupe placebo (P=0.03), mais il n’y a pas eu de différence pour la mortalité cardiovasculaire ou toutes causes au jour 30. Il n’y a pas eu de différence pour l’incidence des IDM non mortels, des AVC postopératoires, de la fibrillation auriculaire ou de la fonction rénale. Les patients du groupe MC-1 et du groupe placebo ont eu des durées de séjour similaires en USI et à l’hôpital (TABLEAU 6). La durée de l’intubation et du drain thoracique a été similaire entre les groupes. Les taux de soutien par ballon de contre-pulsion systolique aortique (2.4%), de dialyse (1.0%), et de cardioversion (3.2%) ont été faibles et similaires entre les groupes. Plus de la moitié des patients assignés dans les groupes MC-1 ou placebo ont reçu une transfusion sanguine après la chirurgie.
|
|

|
Tableau 6. Procédures hospitalières a
|
|
|
Les analyses post hoc basées sur un nouveau calcul du critère primaire utilisant d’autres définitions d’IDM n’ont pas révélé d’effet bénéfique du MC-1 comparé au placebo sur le décès cardiovasculaire et l’IDM non mortel, utilisant des définitions d’IDM basées sur un pic de CK-MB d’au moins 100 ng/ml (8.1% vs 7.3%; P=0.41), d’au moins 70 ng/ml (12.7% vs 11.8%; P=0.43), ou d’au moins 50 ng/ml (19.7% vs 17.3%; P=0.09).
Les événements indésirables choisis pré-spécifiés sont montrés dans le TABLEAU 7. Les taux globaux des autres événements indésirables sévères et non sévères (incluant presque toutes les classes d’organe du système Med-DRA et les termes choisis) ont été similaires entre les patients des groupes MC-1 et placebo. Les nausées et les vomissements, le seul effet indésirable connu lié à la dose de MC-1, ont été plus communs chez les patients assignés au MC-1 que chez ceux assignés au placebo.
|
|

|
Tableau 7. Evénements indésirables sélectionnés a
|
|
|
COMMENTAIRE
 |  |
Dans cette population de patients à risque intermédiaire à élevé subissant un pontage coronaire, un traitement avec l'antagoniste des récepteurs purinergiques MC-1 n'a exercé aucun effet sur le critère composé comprenant le décès cardio-vasculaire ou l'IDM non mortel. Bien que le taux d'événements sous placebo (9.0%) ait été inférieur que prévu, les résultats obtenus excluent avec une certitude de 95% une réduction relative plus importante dans cette population que 17% des décès cardio-vasculaires ou des IDM sous MC-1. Il n'y a eu aucun effet bénéfique du MC-1 dans n'importe quel sous-groupe pré-spécifié ou des d'autres résultats. Les taux plus élevés de mortalité cardio-vasculaire et de toutes causes observés sous MC-1 au jour 4 sont préoccupants, mais compte tenu des taux de mortalité semblables observés à 30 jours, ils sont très probablement dus au hasard.
Bien que le taux d'événement sous placebo ait été sensiblement plus élevé dans la première étude MEND-CABG, selon le schéma, MENDCABG et MEND-CABG II étaient semblables. À la lumière de ces résultats, les résultats post hoc positifs de la première étude MEND-CABG sont très probablement dus au hasard.15 Ces observations illustrent le problème et le risque potentiel d'interpréter des résultats positifs mais statistiquement non significatifs ou post hoc d’essais cliniques de phase 2, relativement petits. Bien que le MC-1 n'ait pas été efficace pour diminuer les lésions myocardiques dans la large population des patients à risque intermédiaire à élevé subissant un pontage coronaire, il est possible que ce médicament puisse être efficace dans des populations choisies, particulièrement à haut risque de lésions d'ischémie-reperfusion, y compris chez des patients présentant un IDM aigu, un choc, ou une chirurgie valvulaire prolongée. En outre, d'autres données préliminaires suggèrent que MC-1, utilisé en association avec le lisinopril, inhbiteur de l’enzyme de conversion de l'angiotensine, pourrait exercer des effets bénéfiques sur la pression artérielle et le métabolisme des lipides chez les patients hypertendus présentant un diabète de type 2.18, 19
En dépit du fait que des patients à haut-risque sont référés de façon croissante pour CABG, la mortalité liée à la chirurgie de CABG isolé a diminué sensiblement au cours de bout plusieurs décennies.2,7,8 Néanmoins, les lésions myocardiques restent un question significative chez les patients subissant un CABG. Le taux élevé d’IDM péri-opératoire observé dans MEND-CABG II est semblable à celui observé dans d'autres études récentes. Dans PREVENT-IV,4 GARDIEN, 20 et PRIMO-CABG, 21 les taux d’IDM péri-opératoire étaient de 9.7%, 9.1%, et 8.0%, respectivement, avec des définitions relativement semblables d’IDM. Dans MEND-CABG II, la définition d’un IDM a exigé une élévation importante des CK-MB à 20 ou plusieurs fois la limite supérieure de la normale du laboratoire central.
Ces taux d’IDM sont plus élevés que ceux cliniquement rapportés (2.4% dans MEND-CABG II et 1.1% dans la Society of Thoracic Surgeons National Cardiac Database).8 Les taux plus élevés d’IDM dans les essais cliniques comparés avec les données des registres basés sur la pratique clinique sont presque certainement le résultat de la surveillance systématique et du rapport obligatoire. Un meilleur diagnostic d’IDM suivant un CABG avec une mesure systématique des CK-MB postopératoires ou de la troponine chez les patients subissant cette procédure peut être un composant important pour améliorer la qualité des soins et les résultats chez les patients subissant une chirurgie cardiaque.
Un certain degré d’élévation des CK-MB se produit chez presque tous les patients subissant un CABG, et le taux d’IDM dépend du seuil d’élévation des CK-MB employé pour définir cet événement. Dans MEND-CABG II, plus de 50% des patients avaient un pic des CK-MB à plus de 5 fois la limite supérieure de la normale et plus de 75% à plus de 3 fois la limite supérieure de la normale. Ces données sont compatibles avec celles de l’étude GARDIEN,20 dans lequel la proportion de patients présentant des élévations postopératoires des CK-MB inférieures à 5 fois, de 5 à moins de 10 fois, de 10 à moins de 20 fois, et de 20 ou plus par rapport à la limite supérieure de la normale avaient respectivement 63.7%, 19.5%, 9.6%, et 7.0%.
Toute augmentation des CK-MB après CABG est suggestive d’une nécrose des myocytes, et les niveaux plus élevés de CK-MB sont susceptibles d'être associés à des résultats plus péjoratifs.22,23 Il a déjà été rapporté qu’il existe une relation linéaire entre l’élévation des CK-MB et la mortalité postopératoire, avec des valeurs postopératoires du pic des CK-MB inférieures à 5 fois, de 5 à moins de 10 fois, de 10 à moins de 20 fois, et de 20 ou plus la limite supérieure de la normale associées à 3.4%, 5.8%, 7.8%, 20.2% de mortalité à six mois, respectivement.20 Un document récent de consensus a recommandé comme définition d’IDM après CABG une élévation des CK-MB d’au moins 5 fois la limite supérieure de la normale pendant les 72 premières heures suivant le CABG, associée à l'apparition de nouvelles ondes Q pathologiques ou d’un bloc de branche gauche, d’une nouvelle sténose documentée du greffon ou d’une artère coronaire native, ou la preuve par imagerie d’une nouvelle perte de myocarde viable.24
MC-1 est l'un parmi plusieurs agents qui ont été étudiés dans la prévention des complications cliniques liées aux lésions d'ischémie-reperfusion au cours de la chirurgie cardiaque avec des résultats infructueux. Le pexelizumab, un anticorps monoclonal anti-C5 recombinant et à chaîne unique, a été étudié dans 2 essais cliniques randomisés, multicentriques, chez des patients subissant un CABG avec ou sans chirurgie valvulaire avec déviation cardio-pulmonaire.21,25 Les patients étaient randomisés pour recevoir une injection bolus de placebo ou de pexelizumab seulement ou un bolus de pexelizumab plus une perfusion. Il n'y a eu aucune différence significative des résultats primaires incluant les décès, les IDM (CK-MB  60 ng/ml), ou une nouvelle altération du système nerveux central, entre le pexelizumab et le placebo.21 L'analyse post hoc a suggéré une réduction du critère composé incluant les décès ou l’IDM (CK-MB 60 ng/ml), ou une nouvelle altération du système nerveux central, entre le pexelizumab et le placebo.21 L'analyse post hoc a suggéré une réduction du critère composé incluant les décès ou l’IDM (CK-MB  100 ng/ml) chez les patients subissant un CABG isolé dans le groupe bolus plus perfusion à 30 jours (3% contre 9% ; P=0.004). Une étude suivante et plus importante chez des patients subissant un CABG isolé n'a cependant pas confirmé cette observation (risque relatif, 0.82 ; intervalle de confiance à 95%, 0.66-1.02).25 100 ng/ml) chez les patients subissant un CABG isolé dans le groupe bolus plus perfusion à 30 jours (3% contre 9% ; P=0.004). Une étude suivante et plus importante chez des patients subissant un CABG isolé n'a cependant pas confirmé cette observation (risque relatif, 0.82 ; intervalle de confiance à 95%, 0.66-1.02).25
On a observé de même des résultats décevants avec le cariporide, un inhibiteur spécifique de l'échangeur sodium-hydrogène. Dans le grand essai GARDIEN,26 11 590 patients présentant un angor instable ou un IDM sans sus-décalage du segment ST subissant une revascularisation percutanée ou chirurgicale ont été aléatoirement affectés pour recevoir un placebo ou 1 à 3 doses de cariporide (20 mg, 80 mg, ou 120 mg, 3 fois quotidiennement). On n'a observé aucune réduction des décès ou des IDM après 36 jours avec le cariporide comparé au placebo. Cependant, la dose la plus élevée de cariporide était associée à une réduction en des décès ou des IDM non mortels chez les patients subissant un CABG (risque relatif, 0.75 ; intervalle de confiance à 95%, 0.59-0.97).26 L’important essai ultérieur, EXPÉDITION, 27 a confirmé cet effet du cariporide en réduisant les décès ou l’IDM après CABG ; cependant, cet avantage était compensé par une croissance significative des AVC.
Un certain nombre d'études ont évalué le rôle de l'adénosine pour diminuer les lésions myocardiques pendant le CABG.28-33 Dans une étude randomisée de phase II sur l’adénosine associée à une cardioplégie à sang froid, les doses les plus élevées d'adénosine ont été associées à une utilisation inférieure de la dopamine en postopératoire et une meilleure fonction ventriculaire gauche postopératoire.30 Une étude plus importante, multicentrique, a confirmé les effets bénéfiques de l'adénosine à la cardioplégie, démontrant une réduction de l’utilisation des vasopresseurs en postopératoire, et bien que de puissance insuffisante, une réduction dépendante de la dose des IDM péri-opératoire et des autres résultats négatifs.31 Une méta-analyse de 5 épreuves comprenant 4043 patients subissant un CABG a indiqué un effet bénéfique substantiel de l'acadésine, nucléoside purinique, sur les résultats combinés comprenant les décès cardio-vasculaires, les IDM, ou les AVC (rapport de cotes, 0.73 ; intervalle de confiance à 95%, 0.57-0.93 ; P=0.01).32 Un essai clinique randomisé ultérieur sur 2698 patients n'a pas démontré de réduction des IDM avec l'acadésine ; cependant, chez les patients présentant un MI péri-opératoire, la mortalité à deux ans était sensiblement inférieure chez ceux recevant de l’acadésine.33 Ceci est un secteur prometteur qui mérite davantage d'étude.
MEND-CABG II a plusieurs limites. Cette étude a inclus des patients à risque intermédiaire à élevé subissant un CABG avec une déviation cardio-pulmonaire. Certains patients à risque plus élevé de lésions d'ischémie-reperfusion durant le CABG, y compris ceux ayant un IDM aigu, un choc, ou une chirurgie en urgence, ceux subissant de plus longues opérations avec une chirurgie valvulaire concomitante, et ceux ayant une maladie rénale plus avancée, n'ont pas été inclus dans cette étude. L'effet du MC-1 sur d'autres populations, en particulier ceux ayant un plus grand risque de lésions d'ischémie-reperfusion, pourrait être différent. En outre, MEND-CABG II a étudié un régime avec un dosage spécifique de MC-1. Bien que l'absorption et la demi-vie plasmatique du MC-1 suggère que des taux adaptés ont été obtenus, la cinétique intracellulaire du MC-1 n'est pas bien connue et il est possible qu'une différente dose ou une stratégie de dosage différente produirait des résultats différents. Bien que le suivi dans MEND-CABG II ait été complet à plus de 99%, un nombre restreint de patients (n=27) a retiré son consentement ou pour d'autres raisons ont été incapables d’accomplir le suivi de 30 jours.
CONCLUSION
MEND-CABG II démontre que chez des patients à risque intermédiaire à élevé subissant un CABG, MC-1, à raison de 250 mg/jour, administré juste avant et pendant 30 jours après la chirurgie n’a pas réduit les décès cardio-vasculaires ou les IDM non mortels. Les lésions myocardiques demeurent un problème significatif après CABG. Des thérapies efficaces pour réduire la morbidité et la mortalité péri-opératoires sont nécessaires, mais restent évasives.
Informations sur les auteurs
Correspondance: John H. Alexander, MD, MHS, Duke University Medical Center, Duke Clinical Research Institute,DUMCBox 3850, Durham, NC 27715 ( john.h.alexander{at}duke.edu).
Publié en ligne: 1 avril 2008 (doi:10.1001/jama.299.15.joc80027).
Auteurs/Groupe de rédaction MEND-CABG II: John H. Alexander, MD, MHS, Duke University Medical Center, Duke Clinical Research Institute, Durham, North Carolina; Robert W. Emery Jr, MD, Minnesota Heart and Vascular Center, Edina, Minnesota; Michel Carrier, MD, Montreal Heart Institute, Montreal, Quebec, Canada; Stephen J. Ellis, PhD, Duke Clinical Research Institute, Durham, North Carolina; Rajendra H. Mehta, MD, MHS, Duke Clinical Research Institute, Durham, North Carolina; Vic Hasselblad, PhD, Duke Clinical Research Institute, Durham, North Carolina; Philippe Menasche, MD, Hospital European George Pompidou, Paris, France; Ahmad Khalil, MD, PhD, Medicure International Inc, Winnipeg, Manitoba, Canada; Robert Cote, MD, Montreal Heart Institute, Montreal, Quebec, Canada; Elliott Bennett-Guerrero, MD, Duke University Medical Center, Durham, North Carolina; Michael J. Mack, MD, Cardiothoracic Surgery Associates of North Texas, Dallas; Gerhard Schuler, MD, University of Leipzig, Leipzig, Allemagne; Robert A. Harrington, MD, Duke University Medical Center, Duke Clinical Research Institute, Durham, North Carolina; Jean-Claude Tardif, MD, Montreal Heart Institute, Montreal, Quebec, Canada.
Contributions des auteurs: Drs Alexander and Ellis ont eu un accès complet à toutes les données de l'étude et accepte la responsabilité de l'intégrité des données et de l'exactitude de l'analyse de données.
Conception et schéma de l’étude: Alexander, Emery, Carrier, Ellis, Hasselblad, Khalil, Cote, Bennett-Guerrero, Harrington, Tardif.
Recueil des données: Alexander, Emery, Schuler, Harrington, Tardif.
Analyse et interprétation des données: Alexander, Emery, Carrier, Ellis, Mehta, Hasselblad, Menasche, Khalil, Mack, Harrington, Tardif.
Rédaction du manuscrit: Alexander, Emery, Mehta, Hasselblad, Tardif.
Revue critique du manuscrit: Emery, Carrier, Ellis, Mehta, Hasselblad,Menasche, Khalil, Cote, Bennett-Guerrero, Mack, Schuler, Harrington, Tardif.
Analyse statistique: Alexander, Ellis, Hasselblad.
Obtention du financement: Alexander, Harrington.
Aide administrative, technique, ou matérielle: Alexander, Khalil, Bennett-Guerrero, Schuler, Harrington, Tardif.
Supervision de l’étude: Alexander, Emery, Carrier, Mehta, Khalil, Cote, Tardif.
Liens financiers: Dr. Alexandre déclare avoir reçu un appui et des honoraires de Medicure International Inc. Le Dr. Bennett-Guerrero déclare avoir un appui institutionnel de recherches et des honoraires de Medicure International Inc. Le Dr Carrier déclare avoir reçu un appui institutionnel de recherches et des honoraires institutionnels de recherches de Medicure International Inc. Le Dr. Cote déclare avoir reçu des honoraires de Medicure International Inc. Le Dr. Ellis déclare avoir reçu un appui et des honoraires institutionnels de recherches de Medicure International Inc. Le Dr Emery déclare avoir reçu des honoraires de Medicure International Inc. Le Dr. Harrington déclare avoir reçu un appui institutionnel de recherches de Medicure inc. international et Procter & Gamble et des honoraires de Procter & Gamble en 2006. Le Dr. Hasselblad déclare avoir reçu un appui et des honoraires institutionnels de recherches de Medicure International Inc. Le Dr. Mack déclare avoir reçu des honoraires de Medicure International Inc. Le Dr. Mehta déclare avoir reçu un appui institutionnel de recherches de Medicure International Inc. Le Dr. Menasche déclare avoir des honoraires de Medicure International Inc. Le Dr. Schuler déclare avoir reçu des honoraires de Medicure International Inc. Le Dr. Tardif déclare avoir reçu un appui institutionnel de recherches et des honoraires de Medicure International Inc. Aucune autre déclaration n'a été rapportée.
Investigateurs MEND-CABG II: G. Walterbusch, Dortmund, Allemagne, St-Johannes-Hospital (103); F. Isgro, Ludwigshafen, Allemagne, Klinikum Ludwigshafen (96); C. Brown, Saint John, New Brunswick, Canada, Saint John Regional Hospital (84); R. Cherukuri, Saginaw, Michigan, St Mary’s of Michigan (84); F. Malik, Charleston, West Virginia, CAMC Health Education & Research Institute Inc (82); A. Zacharias, Toledo, Ohio, St Vincent Mercy Medical Center (81); J. Ladowski, Fort Wayne, Indiana, Indiana Ohio Heart Group (80); N. Baumgartner, Saginaw, Michigan, Covenant Health Care (76); A. Lamy, Hamilton, Ontario, Canada, Hamilton General Hospital (72); S. Boyce, Washington, DC, Washington Hospital Center (71); T. Yau, Toronto, Ontario, Canada, Toronto General Hospital (70); H. Warnecke, Bad Rothenfelde, Germany, Schuechtermann Klinik (70); R. Holmes, Saginaw, Michigan, Bay Regional Medical Center (60); M. Carrier, Montreal, Quebec, Canada, Montreal Heart Institute (51); F. Dagenais, Quebec City, Quebec, Canada, Hospital Laval (51); A. Bouchard, Birmingham, Alabama, Baptist Medical Center (48); C. Roberts, Winchester, Virginia, Winchester Medical Center (47); J. Rich, Norfolk, Virginia, Sentara Norfolk General Hospital (45); S. Kwan, Montgomery, Alabama, Jackson Hospital (45); W. Killinger, Raleigh, North Carolina, Wake Medical Center (44); L. Collazo, Falls Church, Virginia, INOVA Fairfax Hospital (40); N. Kouchoukos, St Louis, Missouri, Missouri Baptist Medical Center (40); A. Hoeft, Bonn, Germany, Universitaets klilnikum Bonn (40); C. Randleman, Birmingham, Alabama, Trinity Medical Center (39); L. Hiratzka, Cincinnati, Ohio, Bethesda North Hospital (39); R. Kirshner, Rochester, New York, Rochester General Hospital (39); M. Leesar and M. Alshaher, Louisville, Kentucky, Jewish Hospital, University of Louisville (37); J. Richardson, Birmingham, Alabama, St Vincent’s Health System (37); T. Christopher, Richmond, Virginia, CJW Medical Center (36); M. Jessen, Dallas, Texas, University of Texas Southwestern Medical Center of Dallas (35); J. Sell, Baltimore, Maryland, St Joseph Medical Center (35); J. Harlan, Birmingham, Alabama, Medical Center East (34); S. Wang, Edmonton, Alberta, Canada, University of Alberta Hospital (33); P. Page, Montreal, Quebec, Canada, Hopital du Sacre Coeur de Montreal (32); H. Vetter, Wuppertal, Germany, HELIOS Klinikum Wuppertal (31); P. Klinke, Victoria, British Columbia, Canada, Victoria General Hospital (30); E. Jamieson, Vancouver, British Columbia, Canada, University of British Columbia–St Paul’s Hospital (30); J. Lee, Winnipeg, Manitoba, Canada, St Boniface General Hospital (29); B. de Varennes, Montreal, Quebec, Canada, Royal Victoria Hospital (29); R. Reynolds, Richmond, Virginia, Henrico’s Doctors Hospital (29); J. Smith and J. Robinson, Cincinnati, Ohio, Bethesda North Good Samaritan Hospital (29); J. Miller, Atlanta, Georgia, St Joseph’s Hospital (28); P. Cammack, Montgomery, Alabama, Drug Research and Analysis Corp (28); N. Moustoukas, New Orleans, Louisiana, East Jefferson Hospital (28); T. Osborn, Tomball, Texas, Tomball Regional Hospital (28); J. Ennker, Lahr, Germany, Herzzentrum Lahr/Baden (28); N. Moustoukas, New Orleans, Louisiana, Touro Infirmary (26); R. Kamienski, Akron, Ohio, Akron General Medical Center (24); D. Kereiakes, Cincinnati, Ohio, Lindner Clinical Trial Center (24); S. Hazelrigg, Springfield, Illinois, Southern Illinois University School of Medi cine (23); R. Bauernschmitt, Muenchen, Germany, Deutsches Herzzentrum Muenchen (23); K. Horvath, Bethesda, Maryland, Suburban Hospital Healthcare Center (21); B. Chandler, Augusta, Georgia, University Hospital (20); N. Ferrier, Rapid City, South Dakota, Rapid City Regional Hospital (20); C. Rabinowitz, San Antonio, Texas, South Texas Cardiovascular Consultants (20); M. Verhofste, Des Moines, Iowa, Iowa Heart Center (20); A. Graeve, Tacoma, Washington, MultiCare Health System (20); J. Todd, Salisbury, Maryland, Peninsula Regional Medical Center (19); C. Dyke, Gastonia, North Carolina, Gaston Memorial Hospital (19); G. Fradet, Vancouver, British Columbia, Canada, Vancouver General Hospital (18); S. Konda, Duluth, Minnesota, Saint Mary’s Medical Centre (18); F. Wanna, Macon, Georgia, Medical Center of Central Georgia (18); M. Bloom, Tampa, Florida, University Community Hospital (18); S. Baradarian, San Diego, California, Sharp Memorial Hospital (18); V. Ferraris, Lexington, Kentucky, Chandler Medical Center/University of Kentucky (17); H. Garrett, Memphis, Tennessee, Baptist Memorial Hospital (16); J. Delehanty, Rochester, NY, University of Rochester Medical Center (16); M. Malias and M. Greene, Melbourne, Florida, Holmes Regional Medical Center (14); P. Walts, Indianapolis, Indiana, Heart Center of Indiana (13); E. Roth, Cincinnati, Ohio, Christ Hospital (13); S. Fremes, Toronto, Ontario, Canada, Sunnybrook Health Sciences Centre (12); B. Rose, St John’s, Newfoundland and Labrador, Health Sciences Centre (12); N. Schwann, Allentown, Pennsylvania, Lehigh Valley Hospital and Health Network (12); J. Copeland, Tucson, Arizona, University of Arizona Health Sciences Center (12); J. Laschinger, Baltimore, Maryland, Union Memorial Hospital (12); D. Gangahar, Lincoln, Nebraska, Nebraska Heart Institute (11); T. Pansegrau, Bismarck, North Dakota, Q & R Clinic (11); C. Hancock-Friesen/J. Sullivan, Halifax, Nova Scotia, Queen Elizabeth II Health Sciences Center (10); A. Maitland, Calgary, Alberta, Canada, Foothills Medical Center (10); C. Hartrick, Royal Oak, Michigan, William Beaumont Hospital (10); A. Holter, St Paul, Minnesota, Regions Hospital (10); E. Hanson, Troy, Michigan, William Beaumont Hospital (10); R. Engelman, Springfield, Massachusetts, Baystate Medical Center (9); R. Jaggers, Fort Smith, Arkanasas, Sparks Regional Medical Center (9); B. Peart, Tucson, Arizona, Southwest Heart Clinic (9); M. Sand, Orlando, Florida, Orlando Regional Health-Care (9); C. Detter, Hamburg, Germany, Universitaeres Herzzentrum Hamburg (9); H. Forst, Augsburg, Germany, Klinikum Augsburg (9); M. Coutu, Sherbrooke, Quebec, Canada, Centre Hospitalier Universitaire De Sherbrooke–Hopital Fleurimont (8); C. Burnett, Olathe, Kansas, Olathe Medical Center (8); M. Chang, Sacramento, California, Mercy Heart Institute (8); R. Ronson, Birmingham, Alabama, Brookwood Ambulatory Care Centre (8); T. Kelly, Sarasota, Florida, Sarasota Memorial Hospital Clinical Research Center (8); E. Bennett-Guerrero, Durham, North Carolina, Duke University Medical Center (7); J. Anderson, Oklahoma City, Oklahoma, INTEGRIS Baptist Medical Center (6); G. Roach, San Francisco, California, Kaiser- Permanente Medical Center (6); J. Morin, Montreal, Quebec, Canada, Sir Mortimer B. Davis Jewish General Hospital (5); N. Shammas, Davenport, Iowa, Genesis Medical Center (5); W. Risher, Bethlehem, Pennsylvania, Saint Luke’s Hospital (5); V. Bethala, Slidell, Louisiana, Slidell Memorial Hospital (5); A. Holter, St Paul, Minnesota, St Joseph’s Hospital (5); P. Ghosn, Montreal, Quebec, Canada, CHUM, Hopital Saint Luc (4); I. Felahy, Stockton, California, St Joseph’s Medical Center (4); F. Keith, Mansfield, Ohio, MedCentral Mansfield Hospital (4); S. Boe, Fort Lauderdale, Florida, Holy Cross Hospital Research Center (4); L. Khitin, Elk Grove Village, Illinois, Chicago Heart Institute and Vein Clinic (4); E. Murphy, Grand Rapids, Michigan, Spectrum Health (4); C. McCoy, Wichita, Kansas, Wesley Medical Center (4); G. Hauf, Bad Krozingen, Germany, Herz-Zentrum Bad Krozingen (4); M. Vidal Melo, Boston, Massachusetts, Massachusetts General Hospital (3); V. DiSesa, West Chester, Pennsylvania, Chester County Hospital (3); V. Paramesh, La Crosse, Wisconsin, Gundersen Clinic Ltd (3); J. Lemmer, Portland, Oregon, Legacy Good Samaritan Hospital (3); A. Levine, Laguna Hills, California, Long Beach Memorial (3); R. Damiano, St Louis, Missouri, Washington University School of Medicine (3); E. Nelson, Houston, Texas, Houston Northwest Medical Center (3); J. Blizzard, Bend, Oregon, St Charles Medical Center, Heart Institute of the Cascades (2); F. Downey, Milwaukee, Wisconsin, Columbia St Mary’s Hospital (2); T. Dewey, Dallas, Texas, Cardiopulmonary Research Science and Technology Institute (2); P. Levy, Albuquerque, New Mexico, New Mexico Heart Institute (2); M. Quader, Omaha, Nebraska, University of Nebraska Medical Center (2); B. Yousuf, Johnson City, New York, United Health Services Hospital (1); R. Lee and R. Johnson, St Louis, Missouri, St Louis University Hospital (1); A. Abolhoda, Orange, California, UCI Medical Center (1); C. Reiter, Temple, Texas, Scott and White Memorial Hospital (1); J. Alexander, Evanston, Illinois, Evanston Northwestern Healthcare (1); M. Cunningham, Los Angeles, California, USC University Hospital (1); M. Gillinov, Cleveland, Ohio, Cleveland Clinic (1); W. O’Hara, Wichita, Kansas, Via Christi Medical Center St Francis (1); M. Bloom, Tampa, Florida, Florida Hospital Zephyrhills (1). Comité scientifique: Robert W. Emery Jr (cochair), Jean-Claude Tardif (cochair), Michel Carrier (co–principal investigator), Robert A. Harrington (co–principal investigator), John H. Alexander, Elliott Bennett-Guerrero, Robert Cote, Vic Hasselblad, Michael J. Mack, Philippe Menasche, Gerhard Schuler and Jan-Ake Westin (Medicure). Bureau de surveillance des données et de la tolérance: Bruce Ferguson (chair), Chris Buller, Lemuel Moye, Uwe Zeymer. Comité des événements cliniques: Philippe L’Allier (chair), Karen Modesto (admin), Jean Gregoire, Reda Ibrahim, Celine Chayer, Sylvain Lanthier.
Financement/soutien: cet essai était sponsorisé par Medicure International Inc, Winnipeg, Manitoba, Canada.
Rôle du sponsor: Le commanditaire a collaboré avec le comité de direction dans la conception et la conduite de l'étude ; dans la collection, la gestion, et l'interprétation des données ; et dans l'examen du manuscrit. Ils n'ont pas participé à l'analyse des données ni n'ont donné d'approbation finale pour le manuscrit. Toutes les analyses statistiques incluses en ce manuscrit ont été exécutées par les Drs Ellis et Hasselblad à l'institut de recherche clinique de Duke. Une partie des salaires des Drs Ellis et de Hasselblad a été pris en charge par des bourses de recherche de Medicure International Inc à la Duke University.
Autres contributions: Nous remercions Elizabeth E. Schramm du Duke Clinical Research Institute pour son aide éditoriale et les investigateurs de MEND-CABG II, les coordinateurs, et les participants de leur contribution précieuse à MEND-CABG II. Mme Schramm n’a pas été compensée pour son travail.
BIBLIOGRAPHIE
 |  |
1. Eagle KA, Guyton RA, Davidoff R, et al. ACC/AHA 2004 guideline update for coronary artery bypass graft surgery: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee to Update the 1999 Guidelines for Coronary Artery Bypass Graft Surgery). Circulation. 2004;110(14):e340-e437.
FREE FULL TEXT
2. Rosamond W, Flegal K, Furie K, et al. Heart disease and stroke statistics—2008 update: a report from the American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Circulation. 2008;117(4):e25-e146.
FREE FULL TEXT
3. Mehta RH, Grab JD, O’Brien SM, et al. Clinical characteristics and in-hospital outcomes of patients with cardiogenic shock undergoing coronary artery bypass surgery: insights from the Society of Thoracic Surgeons National Cardiac Database. Circulation. 2008;117(7):876-885.
FREE FULL TEXT
4. Alexander JH, Hafley G, Harrington RA, et al.; PREVENT IV Investigators. Efficacy and safety of edifoligide, an E2F transcription factor decoy, for prevention of vein graft failure following coronary artery bypass graft surgery: PREVENT IV: a randomized controlled trial. JAMA. 2005;294(19):2446-2454.
FREE FULL TEXT
5. Edwards FH, Clark RE, Schwartz M. Coronary artery bypass grafting: the Society of Thoracic Surgeons National Database experience. Ann Thorac Surg. 1994;57(1):12-19.
FREE FULL TEXT
6. Desai ND, Cohen EA, Naylor CD, Fremes SE. A randomized comparison of radial-artery and saphenousvein coronary bypass grafts. N Engl J Med. 2004;351(22):2302-2309.
PUBMED
7. Plume SK, O’Connor GT, Omstead EM. Changes in patients undergoing coronary artery bypass grafting: 1987-1990: Update in 2000. Ann Thorac Surg. 2001;72(1):314-315.
FREE FULL TEXT
8. Ferguson TB Jr, Hamill PG, Peterson ED, DeLong ER, Glover FL. A decade of change—risk profiles and outcomes for isolated coronary artery bypass grafting procedures, 1990-1999: a report from the STS National Database Committee and the Duke Clinical Research Institute. Ann Thorac Surg. 2002;73(2):480-490.
FREE FULL TEXT
9. Yellon DM, Hausenloy DJ. Myocardial reperfusion injury. N Engl J Med. 2007;357(11):1121-1135.
PUBMED
10. Wang X, Dakshinamurti K, Musat S, Dhalla NS. Pyridoxal 5_-phosphate is an ATP-receptor antagonist in freshly isolated rat cardiomyocytes. J Mol Cell Cardiol. 1999;31(5):1063-1072.
PUBMED
11. Kandzari DE, Dery JP, Armstrong PW, et al. MC-1 (pyridoxal 5_-phosphate): novel therapeutic applications to reduce ischaemic injury. Expert Opin Investig Drugs. 2005;14(11):1435-1442.
PUBMED
12. Wang CX, Yang T, Noor R, Shuaib A. Role of MC-1 alone and in combination with tissue plasminogen activator in focal ischemic brain injury in rats. J Neurosurg. 2005;103(1):165-169.
PUBMED
13. Kandzari DE, Labinaz M, Cantor WJ, et al. Reduction of myocardial ischemic injury following coronary intervention (the MC-1 to Eliminate Necrosis and Damage trial). Am J Cardiol. 2003;92(6):660-664.
PUBMED
14. Tardif JC, Carrier M, Kandzari DE, et al. Effects of pyridoxal-5_-phosphate (MC-1) in patients undergoing high-risk coronary artery bypass surgery: results of the MEND-CABG randomized study. J Thorac Cardiovasc Surg. 2007;133(6):1604-1611.
FREE FULL TEXT
15. Mehta RH, Alexander JH, Emery R, et al. A randomized, double-blind, placebo-controlled, multi-center study to evaluate the cardioprotective effects of MC-1 in patients undergoing high-risk CABG surgery: MEND-CABG II: study rationale and design [published online ahead of print February 21, 2008]. Am Heart J. doi:10.1016/j.ahj.2008.01.002.16. Lancaster HO. Significance tests in discrete distributions. J Am Stat Assoc. 1961;56(294):223-234.
PUBMED
17. Cockcroft DW, Gault MH. Prediction of creatinine clearance from serum creatinine. Nephron. 1976;16(1):31-41.
PUBMED
18. Lefebvre J, Poirier L, Stewart N, Lacourcière Y. The combination of MC-1 and lisinopril has beneficial effects on carbohydrate and lipid metabolism in hyper- tensives with type 2 diabetes mellitus. Abstract presented at: American Society of Hypertension 21st Annual Scientific Meeting and Exposition; May 16, 2006; New York, NY.19. Lacourcière Y, Poirier L, Lefebvre J, Stewart N. Evaluation of the antihypertensive effects of MC-1 alone and in combination with lisinopril on ambulatory BP in hypertensive patients with type 2 diabetes mellitus. Abstract presented at: American Society of Hypertension 21st Annual Scientific Meeting and Exposition; May 17, 2006; New York, NY.20. Klatte K, Chaitman BR, Theroux P, et al. Increased mortality after coronary artery bypass graft surgery is associated with increased levels of postoperative creatine kinase-myocardial band isoenzyme release: results from the GUARDIAN trial. J Am Coll Cardiol. 2001;38(4):1070-1077.
FREE FULL TEXT
21. Verrier ED, Sherman SK, Taylor KM, et al. Terminal complement blockade with pexelizumab during coronary artery bypass graft surgery requiring cardiopulmonary bypass. JAMA. 2004;291(19):2319-2327.
FREE FULL TEXT
22. Costa MA, Carere RG, Lichtenstein SV, et al. Incidence, predictors, and significance of abnormal cardiac enzyme rise in patients treated with bypass surgery in the Arterial Revascularization Therapies Study (ARTS). Circulation. 2001;104(22):2689-2693.
FREE FULL TEXT
23. Brener SJ, Lytle BW, Schneider JP, Ellis SG, Topol EJ. Association between CK-MB elevation after percutaneous or surgical revascularization and threeyear mortality. J AmColl Cardiol. 2002;40(11):1961-1967.
24. Thygesen K, Alpert JS, White HD. Universal definition of myocardial infarction. Eur Heart J. 2007;28(20):2525-2538.
FREE FULL TEXT
25. Shernan SK, Fitch JC, Nussmeier NA, et al. Impact of pexelizumab, an anti-C5 complement antibody, on total mortality and adverse cardiovascular outcomes in cardiac surgical patients undergoing cardiopulmonary bypass. Ann Thorac Surg. 2004;77(3):942-950.
FREE FULL TEXT
26. The roux P, Chaitman BR, Danchin N, et al. Inhibition of the sodium–hydrogen exchanger with cariporide to prevent myocardial infarction in high-risk ischemic situations: main results of the GUARDIAN trial. Circulation. 2000;102(25):3032-3038.27. Mentzer RM Jr.; EXPEDITION Investigators. Effects of Na/H exchange inhibition by cariporide on death and nonfatal myocardial infarction in patients undergoing coronary artery bypass graft surgery: the EXPEDITION study. Presented at: American Heart Association Scientific Sessions 2003; November 9-12, 2003; Orlando, FL.28. Lee HT, LaFaro RJ, Reed GE. Pretreatment of human myocardium with adenosine during open heart surgery. J Card Surg. 1995;10(6):665-676.
PUBMED
29. Fremes SE, Levy SL, Christakis GT, et al. Phase 1 human trial of adenosine-potassium cardioplegia. Circulation. 1996;94(9)(suppl):II370-II375.
PUBMED
30. Mentzer RM Jr, Rahko PS, Molina-Viamonte V, et al. Safety, tolerability, and efficacy of adenosine as an additive to blood cardioplegia in humans during coronary artery bypass surgery. Am J Cardiol. 1997;79(12A)(12A):38-43.31. Mentzer RM, Birjiniuk V, Khuri S, et al. Adenosine myocardial protection: preliminary results of a phase II clinical trial. Ann Surg. 1999;229(5):643-649.
PUBMED
32. Mangano DT. Effects of acadesine on myocardial infarction, stroke, and death following surgery: a meta-analysis of the 5 international randomized trials. JAMA. 1997;277(4):325-332.
FREE FULL TEXT
33. Mangano DT, Miao Y, Tudor IC, Dietzel C. Postreperfusion myocardial infarction: long-term survival improvement using adenosine regulation with acadesine. J Am Coll Cardiol. 2006;48(1):206-214.
FREE FULL TEXT
ARTICLE EN RAPPORT
Cette semaine dans le JAMA français
JAMA. 2008;299:1745.
Texte Complet
|