 |
 |

Effet de la supplémentation en testostérone sur la capacité fonctionnelle, la cognition, et d'autres paramètres chez l'homme âgéUne étude contrôlée randomisée
Marielle H. Emmelot-Vonk, MD;
Harald J. J. Verhaar, MD, PhD;
Hamid R. Nakhai Pour, MD, PhD;
André Aleman, PhD;
Tycho M. T. W. Lock, MD;
J. L. H. Ruud Bosch, MD, PhD;
Diederick E. Grobbee, MD, PhD;
Yvonne T. van der Schouw, PhD
RÉSUMÉ
 |  |
Contexte Les taux de testostérone sériques diminuent
significativement avec l'âge. La supplémentation en
testostérone chez l'homme âgé peut produire des effets
bénéfiques dans le processus de vieillissement.
Objectif Étudier les effets de la supplémentation en
testostérone sur la capacité fonctionnelle, la fonction
cognitive, la densité minérale osseuse, la composition
corporelle, la lipidémie, la qualité de vie, et les
paramètres de tolérance chez les hommes âgés avec
un taux de testostérone normal bas.
Schéma, cadre et participants Étude randomisée,
en double aveugle, contrôlée contre placebo, de 237 hommes en
bonne santé âgés de 60 à 80 ans, avec un taux de
testostérone inférieur à 13,7 nmol/l, menée de
janvier 2004 à avril 2005 dans un centre médical universitaire
des Pays-Bas.
Intervention Les participants ont été
randomisés pour recevoir 80 mg d'undécanoate de
testostérone ou un placebo correspondant, deux fois par jour pendant 6
mois.
Principaux critères de jugement Capacité fonctionnelle
(Stanford Health Assessment Questionnaire [HAQ]), test Get up and Go
chronométré, force isométrique de préhension,
force isométrique des extenseurs de la jambe), fonction cognitive (8
test cognitifs différents), densité minérale osseuse de
la hanche et de la colonne lombaire (absorptiométrie biphotonique aux
rayons X [DEXA]), composition corporelle (DEXA corps entier et
échographie abdominale de la masse graisseuse), facteurs de risques
métaboliques (lipidémie, glycémie et insulinémie
à jeun), qualité de vie (questionnaire de santé SF-36 et
questionnaire sur des modules de satisfaction de vie), et paramètres de
tolérance (taux sériques d'antigène prostatique
spécifique, volume de la prostate à l'échographie, score
IPSS [International Prostate Symptom Score], taux sériques de
créatinine, d'aspartate aminotransférase, d'alanine
aminotransférase, de 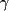 -glutamyl-transférase,
d'hémoglobine, et d'hématocrite). -glutamyl-transférase,
d'hémoglobine, et d'hématocrite).
Résultats Au total, 207 hommes ont achevé
l'étude. Au cours de l'étude, une augmentation de la masse
maigre et une diminution de la masse grasse ont été
observées dans le groupe testostérone comparé au groupe
placebo; cependant, ces facteurs n'étaient pas accompagnés d'une
augmentation de la capacité fonctionnelle ou de la force musculaire.
Aucune modification de la fonction cognitive et de la densité
minérale osseuse n'a été observée. Une
amélioration de la sensibilité à l'insuline a
été constatée, mais avec une diminution du
HDL-cholestérol; à la fin de l'étude, 47,8 % des
participants du groupe testostérone vs 35,5 % du groupe placebo avaient
un syndrome métabolique (p = 0,07). Les mesures de la qualité de
vie étaient similaires, à l'exception de l'amélioration
d'une mesure liée au déficit hormonal. Aucun effet
négatif sur la prostate n'a été observé.
Conclusion La supplémentation en testostérone pendant
6 mois, chez des hommes âgés avec un taux de testostérone
normal bas, n'a produit aucun effet sur le statut fonctionnel ou cognitif; en
revanche, elle a induit une augmentation de la masse maigre et a produit des
effets métaboliques mitigés.
JAMA.
2008;299(1):39-52
Le vieillissement masculin est associé à une
diminution lente mais progressive des taux sériques de
testostérone1
qui affecte plus largement certains hommes que d'autres. La diminution de la
testostérone est associée à de nombreux signes et
symptômes du vieillissement, tels que la réduction de la masse et
de la force musculaires, le déclin cognitif, une diminution de la masse
osseuse, et une augmentation de la masse graisseuse (abdominale).
Malgré l'accroissement rapide de la population de 60 ans ou plus, peu
d'études ont examiné les moyens de prévenir ou de
retarder ces invalidités liées à l'âge. Au cours
des dernières années, les effets antivieillissement potentiels
des hormones sexuelles, dont la testostérone, sont devenus un centre
d'attention.
Les études cliniques évaluant les effets de la
supplémentation en testostérone sur le vieillissement ont
produit des résultats
mitigés.2-5
Ces divergences reflètent probablement des différences dans les
schémas des études, incluant l'âge, le statut gonadique,
et l'état de santé général des populations
étudiées, le type et la durée des traitements, et les
outils adoptés pour étudier le vieillissement. Il est important
de noter que la plupart de ces études avaient des puissances trop
limitées pour détecter des effets, en raison des petites tailles
d'échantillon, et n'examinaient qu'un ou 2 aspects du vieillissement
plutôt que l'intégralité du spectre de ce processus. Des
données complémentaires sont nécessaires pour
déterminer si la supplémentation en testostérone chez les
hommes âgés produit des bénéfices ou des effets
indésirables. En 2004, le comité de l'Institute of Medicine des
Etats-Unis qui évaluait la nécessité d'effectuer des
études cliniques sur le traitement substitutif par testostérone,
a donc recommandé la réalisation d'études
randomisées, contrôlées contre placebo, à court
terme, pour examiner l'efficacité et l'innocuité du traitement
par testostérone chez les hommes avançant en âge, avant
d'engager des études à long
terme.6
Nous avons effectué une étude randomisée, en double
aveugle, contrôlée contre placebo, pour évaluer les effets
de la supplémentation en testostérone sur la capacité
fonctionnelle, la cognition, la densité minérale osseuse, la
composition corporelle, la lipidémie, la qualité de vie, et les
paramètres d'innocuité, chez des hommes âgés avec
un taux de testostérone normal bas, sur une période de 6
mois.
METHODES
Cette étude était randomisée, en double aveugle,
contre placebo. Les détails du schéma, du recrutement, et des
procédures de l'étude ont été publiés
précédemment.7
Le comité d'éthique du Centre médical universitaire
d'Utrecht a approuvé le protocole de l'étude, et tous les
participants ont fourni leur consentement éclairé écrit.
L'étude a été menée de janvier 2004 à avril
2005.
Participants
Les participants ont été recrutés par publicité
directe adressée à 8 020 hommes sélectionnés
aléatoirement, âgés de 60 à 80 ans, dont les
adresses ont été obtenues dans le registre municipal de la ville
d'Utrecht, aux Pays-Bas. La participation n'était pas
rémunérée, mais les frais de déplacement ont
été remboursés.
Les critères d'inclusion comprenaient un taux de testostérone
inférieur au 50ème percentile de la distribution de
testostérone de la population étudiée et un âge
entre 60 et 80 ans. Il a été déterminé que le
seuil du 50ème percentile de testostérone était de 13,7
nmol/L (pour convertir en ng/dL, diviser par 0,0347), après
présélection de 50 candidats. Ce seuil était comparable
au 50ème percentile des taux de testostérone relevés aux
évaluations de présélection des participants potentiels,
tout au long de l'étude (13,8 nmol/L).
Les critères d'exclusion comprenaient un infarctus du myocarde ou un
accident vasculaire cérébral dans les 6 derniers mois ; une
insuffisance cardiaque, sauf si médicalement traitée et non
symptomatique ; une affection maligne dans les 5 dernières
années, sauf le cancer de la peau non-mélanome et l'histoire de
tumeur hormono-dépendante ; les atteintes hépatiques ou
rénales graves (> 3 fois la limite supérieure de la normale)
; les anomalies hématologiques (hémoglobine  7,0 mmol/L
[pour convertir en mg/dL, diviser par 10] et hématocrite 7,0 mmol/L
[pour convertir en mg/dL, diviser par 10] et hématocrite  0,50
[pour convertir en pourcentage, diviser par 0,01], l'épilepsie ou
l'utilisation d'antiépileptiques, la survenue de migraines plus d'une
fois par mois, le diabète sucré, une glycémie à
jeun de 6,9 mmol/L ou plus (pour convertir en mg/dL, diviser par 0,0555),
l'usage de corticoïdes ( 0,50
[pour convertir en pourcentage, diviser par 0,01], l'épilepsie ou
l'utilisation d'antiépileptiques, la survenue de migraines plus d'une
fois par mois, le diabète sucré, une glycémie à
jeun de 6,9 mmol/L ou plus (pour convertir en mg/dL, diviser par 0,0555),
l'usage de corticoïdes ( 7,5 mg/j par voie orale au cours des 6
derniers mois, sauf en cas de brèves périodes de traitement par
prednisone pendant 7,5 mg/j par voie orale au cours des 6
derniers mois, sauf en cas de brèves périodes de traitement par
prednisone pendant  7 jours ou d'inhalation de 7 jours ou d'inhalation de  800 µg/j au cours
des 6 derniers mois), l'utilisation d'esters de testostérone et de
substances similaires au cours des 60 derniers jours, l'histoire d'hyperplasie
de la prostate, et un taux élevé d'antigène prostatique
spécifique (PSA) (âge de 60-69 ans: 800 µg/j au cours
des 6 derniers mois), l'utilisation d'esters de testostérone et de
substances similaires au cours des 60 derniers jours, l'histoire d'hyperplasie
de la prostate, et un taux élevé d'antigène prostatique
spécifique (PSA) (âge de 60-69 ans:  4,5 µg/L (pour
convertir en ng/ml, diviser par 1,0] ; âge 4,5 µg/L (pour
convertir en ng/ml, diviser par 1,0] ; âge  70 ans : 70 ans :  6,5
µg/L). 6,5
µg/L).
Après un premier contact téléphonique, 684 hommes ont
été évalués par interrogatoire, analyses
biologiques, et toucher rectal. Au total, 237 hommes étaient
éligibles à l'étude et ont accepté d'y
participer.
Randomisation et procédure d'aveugle
Après avoir effectué les tests initiaux, les participants ont
été randomisés dans le groupe intervention ou placebo.
Une liste de randomisation sans stratification, par blocs de 6, a
été produite par ordinateur chez Organon NV (Oss, Pays-Bas),
à l'aide du logiciel Almedica Drug Labeling System (Almedica Technology
Group Inc., Allendale, New Jersey). Une boîte contenant le
médicament actif et 1 boîte contenant le placebo ont
été délivrées à la pharmacie du Centre
médical universitaire d'Utrecht, avec la liste de randomisation. Le
personnel de la pharmacie a étiqueté les flacons pour les
participants et délivré le médicament
étudié sur prescription du médecin de l'étude. Des
numéros de randomisation ont été attribués aux
participants par ordre de recrutement dans l'étude.
Le code de randomisation (l'attribution du médicament de
l'étude) était disponible 24 heures sur 24, uniquement à
la pharmacie du Centre médical universitaire d'Utrecht. L'aveugle n'a
pas été levé pendant la période de
l'étude.
Pour évaluer l'efficacité de l'aveugle, il a
été demandé aux participants, à la fin de
l'intervention, s'ils pensaient avoir été assignés au
groupe placebo ou testostérone.
Intervention
L'intervention consistait en l'administration de 2 capsules de 40 mg
d'undécanoate de testostérone (Andriol Testocaps, Organon NV),
deux fois par jour, au petit déjeuner et au dîner
(équivalent à une dose totale de 160 mg/j d'undécanoate
de testostérone), ou du placebo correspondant, pendant une durée
totale de 6 mois. L'obser vance était évaluée par
comptage des capsules à chaque visite de suivi.
Capacité fonctionnelle
Le test Get up and Go chronométré évaluait le temps
nécessaire à un individu pour se lever d'une chaise standard,
marcher sur une distance de 3 mètres, faire demi-tour, revenir et se
rasseoir. Le patient devait s'asseoir le dos appuyé à la chaise,
les bras au repos; le test était effectué 3 fois. Le
délai le plus court était noté, en
secondes.8
Le questionnaire HAQ (Stanford Health Assessment Questionnaire) est un
auto-questionnaire destiné à évaluer la capacité
physique des patients. Nous avons utilisé une version
néerlandaise de ce
questionnaire,9
composée de 24 questions sur les activités quotidiennes,
réparties en 8 catégories: s'habiller, se lever, manger,
marcher, se laver, atteindre et saisir les objets, et d'autres
activités de la vie courante. Toutes les questions comportent 4
solutions au choix, de « aucune difficulté » (score de 0)
à « impossible » (score de 3). En outre, les
répondeurs peuvent indiquer s'ils doivent recourir à une aide ou
à des appareils. Lorsqu'une personne indique devoir recourir à
une aide ou à un appareil sur une question, le score de la
catégorie correspondante est porté à 2 lorsque ce score
était de 0 ou 1. Le score total au questionnaire HAQ est calculé
en prenant le score le plus élevé de chaque catégorie et
en calculant la moyenne des 8 scores des catégories. Ainsi, le score
peut varier de 0 (aucune incapacité) à 3 (complètement
invalide). La force isométrique de préhension a
été mesurée à l'aide d'un dynamomètre
à main réglable (JAMAR Technologies Inc., Horsham,
Pennsylvanie).10
La poignée du dynamomètre était réglée
selon le confort du patient. Les participants se tenaient debout, les
épaules en adduction et en rotation neutre, le bras vertical et le
poignet en position neutre. Ils devaient serrer la poignée avec une
force maximale, en alternant la main gauche et la main droite. Chaque test
était répété au moins 5 fois jusqu'à ce
qu'aucune amélioration ne soit plus observée. La meilleure
mesure de chaque côté, enregistrée en kilogrammes,
était utilisée pour l'analyse. La force isométrique
volontaire maximale des extenseurs du genou a été mesurée
avec le dynamomètre Micro-FET (Hogan Health Industries Inc., West
Jordan,
Utah).11 Les
participants étaient assis sur une table d'examen, la hanche
fléchie à 90°, le genou en extension à 180°, les
jambes passives. Le dynamomètre était posé
perpendiculairement sur chaque membre inférieur en amont des
malléoles. Les participants devaient prendre une ou deux secondes pour
parvenir à l'effort maximal, puis pousser aussi fort que possible
pendant 3 autres secondes, pendant que l'investigateur exerçait une
contre-pression. Cinq contractions volontaires maximales étaient
effectuées de chaque côté ; si l'examinateur
n'était pas sûr qu'un effort maximal était fourni, 2
nouveaux essais étaient réalisés. La meilleure mesure de
chaque côté, enregistrée en newton, était
utilisée pour l'analyse.
Fonction cognitive
Les participants étaient testés dans une pièce
silencieuse, le matin. Des médecins expérimentés
administraient des versions identiques du test, à l'inclusion et
à la fin de l'étude, sauf pour le test de rotation mentale de
Shepard, pour lequel des versions alternatives ont été
utilisées.
La version néerlandaise du test d'apprentissage auditivo-verbal de
Rey permet d'évaluer la mémoire verbale à court terme.
Dans ce test, les participants doivent immédiatement se rappeler 15
mots (rappel immédiat), 5 fois de suite (score maximum de 75), puis
après 15 minutes (rappel différé, score maximum de
15).12
Le test de substitutions de symboles, qui est un sous-test de
l'échelle de Wechsler, mesure la vitesse cognitive et perceptive. On
donne au participant un code qui associe des symboles et des chiffres. Le test
consiste à apparier autant de chiffres que possible avec les symboles
correspondants, dans un délai de 90
secondes.13
Un point est attribué pour chaque réponse correcte.
Le trail-making test consiste en une tâche complexe évaluant
l'attention et la flexibilité mentale. Dans ce test, des pastilles
placées en ordre pseudo-aléatoire, portant des nombres (A1), des
lettres (A2), et des nombres et des lettres (B), doivent être
reliées par une ligne aussi rapidement que possible, dans un ordre
défini. En cas d'erreur, les participants étaient
immédiatement informés et devaient recommencer à partir
du point d'erreur ; la passation du test était
chronométrée. Le temps pris pour effectuer le test sans erreur
était
consigné.14
Le test de jugement d'orientation de lignes de Benton évalue les
processus perceptifs fondamentaux qui contribuent à la perception
spatiale. Dans ce test, le patient doit choisir, parmi 11 lignes
disposées de manière semi-circulaire, les 2 lignes ayant la
même orientation que les 2 segments stimulus, dans l'espace
bidimensionnel.15
Le test comporte 30 items, et les participants obtiennent un point pour chaque
bonne réponse.
La performance visuo-spatiale était évaluée par
l'adaptation de Vandenberg et Kuse du test de rotation mentale en 3 dimensions
de de 20 items, dans lesquels un dessin
Shepard.16
Cette version se compose représentant une ligne stimulus formée
de figures géométriques en trois dimensions et 4 dessins tests
sont présentés au candidat; le candidat doit choisir, parmi 4
dessins, les 2 dessins qui correspondent au stimulus dans différentes
orientations spatiales. Deux versions parallèles du test ont
été administrées, en prenant respectivement les items
impairs et pairs à la première passation (inclusion) et à
la deuxième (après intervention) (10 items pour chaque test).
Ces versions parallèles ont démontré une forte
corrélation et une fiabilité
élevée.17
Ce test est noté en ajoutant 1 point pour chaque bonne réponse
et en soustrayant un point pour chaque mauvaise réponse, ce qui produit
une échelle de-10 (pas de bonne réponse) à 10
(totalité des réponses correctes). Il était
demandé aux participants de « travailler aussi vite que possible,
mais sans sacrifier la précision à la vitesse. » Ils
disposaient de 10 minutes pour effectuer le test.
Densité minérale osseuse
La densité minérale osseuse a été
mesurée par absorptiométrie biphotonique aux rayons X (DEXA)
(Lunar prodigy, GE Healthcare, Waukesha, Wisconsin), à l'inclusion et
à la fin de l'intervention de 6 mois. L'examen était
effectué conformément aux instructions du fabricant. La
densité minérale osseuse était mesurée au niveau
des vertèbres lombaires (L1-L4, séparément et ensemble)
et du fémur proximal (col du fémur, trochanter, intertrochanter,
triangle de Ward, hanche totale et gauche, ou droite si gauche non
disponible). Un contrôle de qualité du DEXA, incluant une
calibration, était effectué systématiquement tous les
matins, en utilisant le protocole fourni par le fabricant.
Composition corporelle
Les mesures de la composition corporelle totale ont été
effectuées par DEXA, avec un appareil de type Lunar prodigy (GE
Healthcare). L'examen a été effectué conformément
aux instructions du fabricant. Le participant était examiné en
décubitus dorsal puis ventral. Les jambes et les pieds étaient
tournés vers l'intérieur et attachés ensemble. La masse
grasse et la masse maigre ont été calculées. Un
contrôle de qualité, incluant une calibration, était
effectué systématiquement chaque matin pour le DEXA,
conformément au protocole fourni par le fabricant.
Une échographie de la masse grasse a été
effectuée chez tous les participants avec un matériel de type
Ultramark 9 (Advanced Technology Laboratories, Bothell, Washington). Les
distances entre le bord postérieur des muscles abdominaux et la colonne
lombaire ou les muscles psoas ont été mesurées à
l'aide de compas électroniques. Pour toutes les images, le transducteur
était placé sur une ligne droite tracée entre le point
central gauche et droit de la dernière côte et de la crête
iliaque. Une marque était faite au centre, à 10 cm des
côtés gauche et droit. Les distances étaient
mesurées depuis 3 angles différents : médian, gauche et
droit pour la masse grasse intra-abdominale, et médian pour la masse
grasse sous-cutanée. Les mesures ont été
effectuées à la fin d'une expiration calme, en appliquant une
pression minimale sans déplacer le contenu intra-abdominal, sous
contrôle échographique.
Données biologiques
Les prélèvements sanguins à jeun ont été
effectués avant l'administration du médicament
étudié, et entre 8 h 00 et 11 h 00 pour minimiser les variations
diurnes. Les taux sériques de testostérone et de SHBG (sex
hormone-binding globulin) ont été mesurés par
immuno-enzymologie chimioluminescente compétitive à phase solide
(Immulite 2000, Diagnostic Products Corporation, Los Angeles, Californie),
à l'inclusion et à la fin de l'étude. Les taux de
testostérone libre et biodisponible ont été
calculés à partir des concentrations totales de
testostérone, de SHBG, et
d'albumine.18
La glycémie à jeun a été évaluée
à l'aide d'un réflectomètre GlucoTouch (LifeScan Inc,
Beerse, Belgique), une méthode utilisant des bandelettes
réactives imprégnées de glucose-oxydase. Le sang veineux
était immédiatement déposé sur la bandelette
test.
Les taux d'insuline à jeun, de cholestérol total, de HDL
(high-density lipoprotein)-cholestérol, et de triglycérides ont
été mesurés au moyen de tests disponibles dans le
commerce, à l'inclusion et à la visite finale. Le LDL
(low-density lipoprotein) -cholestérol a été
calculé par l'équation de
Friedewald.19
Pour évaluer la sensibilité à l'insuline, nous avons
calculé les index HOMA-IR (homeostasis model assessment of insulin
resistance) et QUICKI (quantitative insulin sensitivity check index). L'index
HOMAR-IR a été calculé par la formule suivante: HOMA-IR =
[insuline à jeun en mU/L X glycémie à jeun en
mmol/L]/22,5. Le QUICKI a été calculé par la formule
QUICKI = 1/[log (insuline à jeun en mU/L) + log (glycémie
à jeun en mg/dL)].
Nous avons utilisé les index HOMA-IR et QUICKI pour évaluer
la résistance et la sensibilité à l'insuline. Même
si le clamp euglycémique hyperinsulinémique est la
méthode de référence pour mesurer l'insulino
résistance, toutes nos mesures ont été validées et
ont démontré une forte corrélation avec l'insulino
résistance mesurée par la technique du clamp (coefficients de
corrélation de respectivement -0,82 et
0,81).20-22
Pression artérielle, syndrome métabolique et qualité de vie
Les pressions artérielles systolique et diastolique ont
été mesurées deux fois au bras et diastolique ont
été mesurées deux fois au bras gauche, en position assise
après 5 minutes au repos, à l'aide d'un appareil
oscillométrique automatique calibré (Omron Healthcare Europe,
Hoofddorp, Pays-Bas). Les pressions artérielles systolique et
diastolique moyennes ont ensuite été calculées.
Le syndrome métabolique, conformément au 3ème rapport
du NCEP (National Cholesterol Education Program Adult Treatment Panel
III),23
était défini comme présent si 3 des critères
suivants ou plus étaient remplis : glycémie à jeun d'au
moins 6,1 mmol/L, triglycérides sériques d'au moins 1,7 mmol/L,
HDL-cholestérol sérique de moins de 1,0 mmol/L, pression
artérielle systolique/diastolique d'au moins 130/85 mm Hg, ou tour de
taille de plus de 102 cm.
La qualité de vie était évaluée à l'aide
du questionnaire de santé SF-36 (Short-Form 36) en questionnaire
générique sur la qualité de vie, et du questionnaire sur
des modules de satisfaction de vie en questionnaire spécifique au
déficit hormonal.
Le SF-36 comprend 9 mesures du fonctionnement incluant (1) le
fonctionnement physique; (2) le fonctionnement social ; (3) les limitations de
rôle liées à des problèmes de santé
(rôle physique) ; (4) les limitations de rôle liées
à des problèmes émotionnels (rôle
émotionnel) ; (5) la santé mentale; (6) la vitalité;(7)
la douleur corporelle;(8) la perception de l'état de santé
général ; et (9) les changements observés dans la
santé par rapport au mois précédent. Les scores bruts ont
été convertis en une échelle standardisée variant
de 0 à 100, le score le plus élevé représentant le
meilleur
statut.24
Le questionnaire sur des modules de satisfaction de vie est traduit des
Fragen zur Lebenszufriedenheit selon la méthode décrite par
Huber et
coll.25 Ce
questionnaire est complété par un module sur
l'hypopituitarisme,26
et est divisé en une partie générale, une partie
médicale, et une partie sur le déficit hormonal -les 2
premières parties incluent 8 items, et la dernière en inclut 16
(résilience ou tolérance au stress, forme corporelle, confiance
en soi, capacité à être stimulé sexuellement,
concentration, endurance physique, initiative ou conduite, capacité
à gérer sa propre colère, capacité à
supporter le bruit et le tapage, poids, taille, sommeil, maîtrise de
soi, mémoire ou pensées claires, capacité à se
détendre, relations sociales). Tous les items étaient
notés sur une échelle de 5 points, en fonction de leur
importance individuelle (I) et du degré de satisfaction (S). En mesures
d'effet, une combinaison de l'importance et de la satisfaction (I-1) X (S X
2-5) a été calculée, et la somme des valeurs
combinées a été effectuée pour chaque partie. Les
scores des parties générale et médicale peuvent varier de
-96 à 160, et les scores de la partie hormonale de -192 à 320.
Plus les scores sont élevés, meilleur est le statut de
qualité de vie.
Innocuité
L'innocuité de la supplémentation en testostérone a
été évaluée en mesurant les fonctions prostatique,
hépatique et rénale, ainsi que des paramètres
hématologiques. Les effets sur la prostate ont été
étudiés en utilisant les taux de PSA, l'échographie
transrectale de la prostate, et le score IPSS. Les taux de PSA sériques
ont été mesurés par dosage immunométrique
(Immulite 2000) à l'inclusion, à la semaine 13, et à la
fin de l'étude. Les coefficients de variation intra-dosage et
inter-dosage étaient respectivement de 3,5 % et 5,0 %. Les
augmentations de 1,4 µg/L ou plus au-dessus des taux initiaux, lors de 2
mesures consécutives pendant 1 à 2 semaines, justifiaient
l'arrêt du traitement.
Une échographie transrectale biplan de la prostate, avec une sonde
transrectale de 7 MHz (modèle 2101 Falcon, Brüel et Kjaer, Naerum,
Pays-Bas), a été effectuée à l'inclusion et
à la fin de l'étude par un urologue expérimenté.
Pour chaque participant, le volume de la prostate totale a été
déterminé selon une technique par compas : hauteur X largeur x
longueur x
 /6.27 En
outre, une attention particulière a été portée
à la présence de lésions hypoéchogènes dans
la prostate. Les critères échographiques pour le cancer de la
prostate décrits par Lee et
coll.28 ont
été utilisés. En cas de détection d'anomalie, les
patients étaient adressés en consultation externe d'urologie
pour des examens complémentaires. /6.27 En
outre, une attention particulière a été portée
à la présence de lésions hypoéchogènes dans
la prostate. Les critères échographiques pour le cancer de la
prostate décrits par Lee et
coll.28 ont
été utilisés. En cas de détection d'anomalie, les
patients étaient adressés en consultation externe d'urologie
pour des examens complémentaires.
Le score IPSS a été développé par l'American
Urological Association, et se compose de 7 questions relatives aux
symptômes
urologiques.29
Les questions sont notées de 0 (aucune plainte) à 5 (presque
constantes). Les scores cumulés des 7 questions indiquent la
sévérité des symptômes des voies urinaires
inférieures. Le score maximum est de 35. Le questionnaire IPSS
était administré à l'inclusion, après 6 et 13
semaines, et à la fin de l'étude.
La fonction hépatique (aspartate aminotransférase [ASAT],
alanine aminotransférase [ALAT], phosphatase alcaline [PA], et
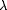 -glutamyltransférase [GGT]), la fonction rénale
(albumine et créatinine), et les paramètres
hématologiques (hémoglobine et hématocrite)
étaient évalués par dosage sérique sur
autoanalyseurs standard (Synchron LX, Beckman, Coulter, Fullerton, Californie)
à l'inclusion, après 13 semaines, et à la fin de
l'étude. Pendant l'étude, les taux d'hémoglobine de 7
mmol/L ou moins, d'hématocrite de 0,50 ou plus, d'enzymes
hépatiques supérieures à 3 fois la limite
supérieure de la normale (ALAT : 10-50 U/L ; PA : 40-130 U/L ; ASAT :
15-45 U/L ; et GGT : 15-70 U/L [pour convertir l'ALAT, la PA, l'ASAT et la GGT
en µkat/L, multiplier par 0,0167], ou les taux de créatinine de 180
µmol/L ou plus (pour convertir en mg/dL, diviser par 88,4),
entraînaient la réalisation d'un bilan sanguin
complémentaire après une semaine. Si les valeurs restaient trop
élevées, les participants sortaient de l'étude. Toutes
les analyses biologiques ont été effectuées au
laboratoire Sho (Velp, Pays-Bas). -glutamyltransférase [GGT]), la fonction rénale
(albumine et créatinine), et les paramètres
hématologiques (hémoglobine et hématocrite)
étaient évalués par dosage sérique sur
autoanalyseurs standard (Synchron LX, Beckman, Coulter, Fullerton, Californie)
à l'inclusion, après 13 semaines, et à la fin de
l'étude. Pendant l'étude, les taux d'hémoglobine de 7
mmol/L ou moins, d'hématocrite de 0,50 ou plus, d'enzymes
hépatiques supérieures à 3 fois la limite
supérieure de la normale (ALAT : 10-50 U/L ; PA : 40-130 U/L ; ASAT :
15-45 U/L ; et GGT : 15-70 U/L [pour convertir l'ALAT, la PA, l'ASAT et la GGT
en µkat/L, multiplier par 0,0167], ou les taux de créatinine de 180
µmol/L ou plus (pour convertir en mg/dL, diviser par 88,4),
entraînaient la réalisation d'un bilan sanguin
complémentaire après une semaine. Si les valeurs restaient trop
élevées, les participants sortaient de l'étude. Toutes
les analyses biologiques ont été effectuées au
laboratoire Sho (Velp, Pays-Bas).
Événements indésirables
Un événement indésirable était défini
par tout événement médical défavorable chez un
participant, n'ayant pas nécessairement de relation causale avec le
traitement. Un événement indésirable pouvait donc
être tout signe (incluant un résultat biologique anormal),
symptôme, ou maladie, défavorables et imprévus,
temporairement associés à l'utilisation d'un médicament,
qu'ils soient ou non considérés comme liés au
médicament.
Les données concernant les événements
indésirables étaient obtenues en interrogeant ou en examinant
les participants. À chaque visite de la période de traitement,
toutes nouvelles plaintes et symptômes (c'est-à-dire ceux
n'existant pas avant la période de traitement) étaient
notés sur le formulaire de déclaration
d'événements indésirables. Les plaintes ou les
symptômes préexistants, qui augmentaient en intensité ou
en fréquence pendant la période de traitement, étaient
également reportés dans le formulaire de déclaration
d'événements indésirables. Un événement
indésirable grave était défini par tout incident
médical entraînant le décès, engageant le pronostic
vital, nécessitant l'hospitalisation, ou induisant une
invalidité ou une incapacité persistante ou significative. Tous
les événements indésirables graves étaient
rapportés au comité d'éthique et à Organon NV.
Analyse des données
Nous avons effectué les calculs de puissance en nous basant sur le
critère de jugement primaire, le test des 15 mots sur la fonction
cognitive. Le nombre prévu de participants était de 240 au
total, soit 120 dans chaque groupe d'intervention. Ce nombre était
basé sur les hypothèses conventionnelles d'un seuil  de
0,05 et d'un seuil β de 0,20, avec un taux d'abandon de 15 % dans le
groupe d'intervention et une amélioration de 18 % au test des 15 mots
(équivalent à une amélioration de 6 mots). de
0,05 et d'un seuil β de 0,20, avec un taux d'abandon de 15 % dans le
groupe d'intervention et une amélioration de 18 % au test des 15 mots
(équivalent à une amélioration de 6 mots).
Les données ont été analysées selon un principe
d'intention de traiter modifié, incluant tous les participants ayant
effectué 2 évaluations, dont l'inclusion, dans les groupes
auxquels ils étaient assignés. Conformément au protocole,
une deuxième visite était effectuée après 3 mois,
et une visite finale après 6 mois. Lorsqu'un participant restait dans
l'étude pendant moins de 3 mois, la deuxième visite ou visite
finale n'était pas effectuée, aucun bénéfice
n'étant attendu dans ce délai. Lorsqu'un participant abandonnait
l'étude entre 3 et 6 mois, une visite finale était
effectuée au moment du retrait.
Les changements entre la visite finale et l'inclusion pour les variables
continues étaient exprimés en moyennes avec un intervalle de
confiance (IC) à 95 % ; des tests t non appariés ont
été utilisés pour évaluer la différence
dans les changements entre les groupes de traitement. Toutes les comparaisons
étaient bilatérales et le seuil de significativité
défini était une valeur de p inférieure à 0,05.
Dans la mesure où le pourcentage de données manquantes
était très faible (<3,6 %), nous n'avons pas utilisé
de méthode spécifique d'imputation, et les données 11.0
manquantes ont été traitées en valeurs manquantes dans
l'analyse. Dans une autre analyse, nous avons imputé des valeurs
manquantes en utilisant une méthode d'imputation par la
régression. Nous avons en outre effectué une analyse en ajustant
la différence des résultats sur toute différence initiale
potentielle (taux de testostérone, âge, tabagisme, consommation
d'alcool, pression artérielle, et indice de masse corporelle). Une
analyse de variance avec mesures répétées a
été utilisée pour tester la significativité
statistique des effets de la testostérone vs placebo pour les
paramètres d'innocuité. Toutes les analyses ont
été effectuées avec le logiciel statistique SPSS, version
11.0 (SPSS Inc., Chicago, Illinois).
RÉSULTATS
L'organigramme du recrutement et de l'inclusion des participants dans
l'étude est présenté dans la
FIGURE. Entre janvier 2004 et
octobre 2004, nous avons randomisé 237 hommes, dont 120 dans le groupe
testostérone et 117 dans le groupe placebo. Il y a eu 30 sorties
prématurées, dont 16 dans le groupe testostérone et 14
dans le groupe placebo. Parmi les retraits, 7 participants de chaque groupe
n'avaient pas de données de suivi. L'analyse primaire a donc inclus 113
participants du groupe testostérone et 110 du groupe placebo. Les
caractéristiques initiales des 2 groupes étaient similaires
(TABLEAU 1).
|
|

|
|
Figure 1.. Organigramme des participants
Pour convertir la glycémie à jeun en mg/dL, diviser par
0,0555.
|
|
|
|
|

|
|
Tableau 1.. Caractéristiques des participants à l'inclusion par groupe de
randomisation
Facteurs de conversion SI: Pour convertir l'albumine en g/dL, diviser par
10 ; la testostérone en ng/dL, diviser par 0,0347.
a Calculé par le poids en kilogrammes divisé par
le carré de la taille en mètres.
b Inclut l'infarctus du myocarde, l'angor, l'hypertension, ou
l'AVC.
|
|
|
L'observance, évaluée par comptage des capsules
retournées, était bonne dans les deux groupes : plus de 90 % des
participants ont utilisé au moins 80 % de leurs médicaments.
L'aveugle quant aux groupes de traitement a été efficace ; des
proportions égales de participants des 2 groupes ont pensé
qu'ils recevaient le traitement actif (test X2, p = 0,98).
À 6 mois, la testostérone totale était
inchangée par rapport à l'inclusion dans le groupe
testostérone, et présentait une légère
augmentation dans le groupe placebo; la différence entre les groupes
testostérone et placebo à 6 mois était de -3,2 nmol/L (IC
95 %, -4,2 à -2,2 ; p < 0,001). Les taux de SHBG ont diminué
par rapport à l'inclusion dans le groupe testostérone, mais pas
dans le groupe placebo (différence, -10,1 nmol/L [IC 95 %, -11,7
à -8,5] ; p < 0,001). La différence intergroupe pour la
testostérone libre et biodisponible était statistiquement
significative à 6 mois (différence de la testostérone
libre, -0,03 [IC 95 %, -0,05 à 0] ; p = 0,04 et différence de la
testostérone biodisponible, -0,69 [IC 95 %, -1,24 à -0,13]; p =
0,02, respectivement).
Les participants des 2 groupes n'ont présenté aucune
variation significative dans le score du questionnaire HAQ ; la force
isométrique de préhension, la force isométrique des
extenseurs de la jambe, et le test Get up and Go chronométré
n'étaient pas influencés par le traitement par
testostérone comparé au placebo
(TABLEAU 2). Les deux groupes
présentaient une augmentation des scores de la fonction cognitive sur
la plupart des tests à 6 mois ; cependant, les faibles, et la variation
dans la cognition ne différait pas entre les groupes. Ni le groupe
testostérone ni le groupe placebo ne présentaient de changements
significatifs dans la densité minérale osseuse à l'un
quelconque des sites. La masse grasse corporelle totale et le pourcentage de
graisse corporelle ont significativement diminué dans le groupe
testostérone, tandis que le groupe placebo est resté stable
après traitement. La masse maigre corporelle totale a significativement
augmenté dans le groupe testostérone par rapport au groupe
placebo. L'indice de masse corporelle et la masse grasse intra-abdominale
mesurée à l'échographie ne présentaient pas de
différence significative.
|
|

|
|
Tableau 2.. Variables de capacité fonctionnelle, de fonction cognitive, de
densité minérale osseuse, et de composition corporelle par
groupe de traitement
Abréviation : IC, intervalle de confiance.
a Certaines données étaient manquantes, mais le
pourcentage des valeurs manquantes ne dépassait jamais 3,6 %.
b Calculé par le poids en kilogrammes divisé par
le carré de la taille en mètres.
|
|
|
À la fin de l'étude, tant le cholestérol total que le
HDL-C ont significativement diminué dans le groupe testostérone,
produisant une augmentation significative du ratio cholestérol
total/HDL-C dans le groupe testostérone comparé au groupe
placebo (TABLEAU 3). Les
triglycérides et le LDL-cholestérol n'ont pas
présenté de variation significative. Les taux de glucose et
d'insuline ont significativement augmenté dans le groupe placebo
comparé au groupe testostérone. Une diminution de l'index QUICKI
(sensibilité à l'insuline) a été observée,
parallèlement à une augmentation significative de l'index
HOMA-IR (insulinorésistance) dans le groupe placebo.
|
|

|
|
Tableau 3.. Variables de glycémie, d'insulinémie, de lipidémie et
de syndrome métabolique par groupe de traitement
Abréviations : IC, intervalle de confiance ; HDL, high-density
lipoprotein ; LDL, low-density lipoprotein.
Facteurs de conversion SI : Pour convertir le glucose des mmol/L en mg/dL,
diviser par 0,0555 ; le cholestérol total, le HDL-cholestérol,
le LDL-cholestérol des mmol/L en mg/dL, diviser par 0,0259 ; les
triglycérides des mmol/L en mg/dL, diviser par 0,0113.
a Certaines données étaient manquantes, mais le
pourcentage des valeurs manquantes ne dépassait jamais 3,6 %.
b Pourcentage de participants répondant aux
critères composites (tour de taille, glycémie, pression
artérielle, HDL-cholestérol, triglycérides) du syndrome
métabolique.
|
|
|
À la fin de l'étude, une plus forte majoration du syndrome
métabolique a été observée dans le groupe
testostérone (de 34,5 % à l'inclusion à 47,8 %
après 6 mois) comparé au groupe placebo, mais qui était
non significative (p = 0,07; Tableau
3). Cette augmentation était spécifiquement
liée à la réduction du taux de HDL-cholestérol
dans le groupe testostérone.
Les scores du SF-36 n'ont significativement varié dans le groupe
testostérone comparé au groupe placebo, pour aucune des 9
catégories relatives au fonctionnement
(TABLEAU 4). Les
résultats du questionnaire sur les modules de satisfaction de vie
étaient également similaires dans les 2 groupes, pour la
qualité de vie en général et pour celle liée
à la santé. Seuls les résultats de la partie
qualité de vie liée au déficit hormonal
différaient significativement entre les groupes (résultats
disponibles sur demande auprès des auteurs).
|
|

|
|
Tableau 4.. Variables de qualité de vie par groupe de traitement
Abréviation : IC, intervalle de confiance.
a Certaines données étaient manquantes, mais le
pourcentage de valeurs manquantes ne dépassait jamais 3,6 %. Lorsque
des données étaient imputées, la valeur de p pour le
questionnaire de Herschbach sur la partie concernant le déficit
hormonal passait à 0,03.
|
|
|
Le volume de la prostate et le taux de PSA ne variaient pas
significativement dans le groupe testostérone comparé au groupe
placebo. Le nombre de symptômes des voies urinaires inférieures,
eures, évalué par le score IPSS, était similaire dans les
2 groupes. Pendant l'étude, 8 participants ont présenté
une augmentation du taux de PSA de 1,4 µg/L ou plus (3 dans le groupe
testostérone et 5 dans le groupe placebo ; 6 pendant les 3 premiers
mois et 2 à la fin de l'étude), qui a nécessité
leur retrait de l'étude. Quatre participants ont présenté
une lésion hypoéchogène, à l'échographie de
la prostate de la fin de l'étude (2 dans le groupe testostérone
et 2 dans le groupe placebo). Un participant présentait une anomalie
potentielle de la vessie dans le groupe placebo à la fin de
l'étude. L'exploration complémentaire de ces anomalies a
révélé 2 cancers de la prostate dans le groupe placebo.
Il n'y avait pas de différence significative dans la fonction
hépatique, mais la créatinine était plus
élevée dans le groupe testostérone, à la limite de
la significativité (p = 0,05). Un participant du groupe
testostérone a arrêté le médicament
étudié en raison de valeurs des enzymes hépatiques
supérieures à 3 fois la limite supérieure de la normale.
Après arrêt du traitement, la fonction hépatique s'est
normalisée. Les taux d'hémoglobine et d'hématocrite ont
significativement augmenté dans le groupe testostérone
comparé au groupe placebo. Cette augmentation est survenue dans les 3
premiers mois, et est restée stable par la suite (données
disponibles sur demande). Deux participants ont développé des
paramètres érythrocytaires juste au-dessus des limites de la
normale à la fin de l'étude ; les autres n'ont pas atteint les
taux d'hémoglobine et d'hématocrite prédéfinis
pour l'arrêt du médicament étudié
(TABLEAU 5).
|
|

|
|
Tableau 5.. Variables d'innocuité par groupe de traitement
Abréviation : Intervalle de confiance.
Facteurs de conversion SI : Pour convertir l'alanine
aminotransférase, l'aspartate aminotransférase, la phosphatase
alcaline, et la 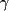 -glutamyltransférase en µkat/L, multiplier
par 0,0167 ; la créatinine en mg/dL, diviser par 88,4;
l'hématocrite, multiplier par 0,01 ; l'hémoglobine en mg/dL,
diviser par 10 ; les PSA en ng/mL, diviser par 1,0. -glutamyltransférase en µkat/L, multiplier
par 0,0167 ; la créatinine en mg/dL, diviser par 88,4;
l'hématocrite, multiplier par 0,01 ; l'hémoglobine en mg/dL,
diviser par 10 ; les PSA en ng/mL, diviser par 1,0.
a Certaines données étaient manquantes, mais le
pourcentage de valeurs manquantes ne dépassait jamais 3,6 %.
b P La valeur de p concerne l'analyse de variance à
mesures répétées sur l'ensemble des 3 temps
d'évaluation.
c Le volume de la prostate n'était pas mesuré
à 13 semaines.
|
|
|
Un total de 129 participants (54,3 %) a présenté 1
événement indésirable ou plus
(TABLEAU 6). Le nombre moyen
d'événements indésirables par participant était de
0,87 dans le groupe testostérone et de 0,90 dans le groupe placebo. Les
événements indésirables les plus fréquents
étaient gastro-intestinaux, intestinaux, cardiovasculaires et
urologiques. Les types d'événements indésirables ne
différaient pas significativement entre les groupes.
|
|

|
|
Tableau 6.. Événements indésirables par groupe de traitement
|
|
|
Au cours de l'étude, 15 événements indésirables
graves ont été rapportés, dont 5 dans le groupe
testostérone et 10 dans le groupe placebo ; 13 étaient des
hospitalisations, sur lesquelles 5 étaient prévues avant le
début de l'étude. Les hospitalisations n'étaient pas
liées au médicament étudié. Les 2 autres
événements indésirables graves étaient les 2
cancers de la prostate du groupe placebo, décrits
précédemment.
L'ajustement des différences des données sur les
différences initiales n'a pas influencé les résultats
(disponibles sur demande). L'imputation de variables manquantes a produit 2
changements substantiels dans les valeurs de p : la valeur de p pour la
différence dans la testostérone biodisponible est passée
de 0,02 à 0,12, et celle pour la différence dans le
questionnaire de Herschbach sur le déficit hormonal est passée
de 0,008 à 0,03.
COMMENTAIRE
Dans cette vaste étude randomisée, en double aveugle,
contrôlée contre placebo, nous avons trouvé que la
supplémentation par 80 mg d'undécanoate de testostérone
par voie orale, deux fois par jour pendant 6 mois, chez des hommes
âgés avec un taux de testostérone circulant normal bas,
augmentait la masse maigre et réduisait la masse grasse corporelle,
sans améliorer la capacité fonctionnelle ni la force musculaire.
Aucun effet bénéfique sur la cognition ou la densité
minérale osseuse n'a été observé. La
réduction de la masse grasse était accompagnée d'une
réduction du cholestérol total et du HDL-C, produisant une
augmentation du ratio cholestérol total/HDL. La réduction de la
masse grasse était également accompagnée d'une
réduction de la glycémie, associée à une
augmentation de la sensibilité à l'insuline. Dans le groupe de
traitement par testostérone, les mesures de la qualité de vie ne
différaient pas, en dehors de celle liée au déficit
hormonal. Les événements indésirables ne
différaient pas significativement dans les 2 groupes.
Pour bien appréhender ces résultats, certains points doivent
être pris en compte. Premièrement, le taux de testostérone
dans la population étudiée était de bas à normal
bas. Soixante et onze pour cent des hommes avaient un taux de
testostérone inférieur à 12,0 nmol/L, et sont
considérés comme potentiellement déficients en
testostérone selon les normes
conventionnelles.30
Les taux de testostérone des participants étaient comparables
à ceux d'autres études qui ont trouvé des effets
bénéfiques à court terme de la supplémentation en
testostérone.31,32
Dans cette étude, les hommes étaient
sélectionnés sur la base de leur statut androgène et non
de leur statut médical ou de symptômes pouvant indiquer une
diminution des taux de testostérone ; la plupart des participants
étaient en bonne santé et n'avaient aucun problème de
santé majeur préexistant.
Six mois représentent une période relativement courte pour un
traitement de supplémentation. Cependant, d'autres études avec
une période d'intervention plus courte ont démontré
l'efficacité de ce traitement.
31,33,34
En outre, pour les critères retenus, les effets, le cas
échéant, devaient être obtenus en 6 mois, sauf pour la
densité minérale osseuse, qui peut nécessiter un
traitement plus long.
La dose quotidienne totale de 160 mg d'undécanoate de
testostérone par voie orale, adoptée dans cette étude, a
été utilisée dans la pratique clinique et dans d'autres
études.35,36
L'absence de supplémentation orale par capsules d'undécanoate de
testostérone, et s'accorde avec d'autres
études.35,36
En raison du profil pharmacocinétique de l'undé- canoate de
testostérone orale, les taux de testostérone mesurés dans
un prélèvement sanguin unique sont fortement dépendants
du moment du prélèvement par rapport à celui de
l'ingestion des capsules. Bien qu'aucune augmentation n'ait été
observée dans le taux de testostérone final, diverses
études ont démontré que le profil pharmacologique de
l'undécanoate de testostérone induit un accroissement des taux
de testostérone pendant la quasi-totalité des 24
heures,37,38
qui entraîne une variation du taux d'hormones circulant et la survenue
de changements physiologiques significatifs. Malheureusement, nous n'avons pas
pu mesurer de taux post-administration, qui auraient été
incontestablement supérieurs. Dans le groupe placebo, nous attribuons
largement l'augmentation de la testostérone à la
régression à la moyenne, parce que nous n'avons mesuré
les taux de testostérone qu'une seule fois. Des doses plus
élevées auraient pu produire des effets plus divers ou plus
marqués, mais les risques impliqués ne sont pas connus. En
outre, cette étude a révélé les mêmes effets
biochimiques (augmentation de l'hématocrite) et physiques
(réduction de la masse grasse et augmentation de la masse maigre)
statistiquement significatifs que des études rapportant une
augmentation des taux sériques de testostérone avec un
traitement par testostérone intramusculaire ou transdermique. Enfin,
lors de l'élaboration de cette étude, les patchs et les gels,
qui produisent des taux de testostérone plus constants,
n'étaient pas disponibles aux Pays-Bas.
L'observance du traitement est toujours problématique. Cependant,
d'après le comptage des pilules, plus de 90 % des participants ayant
achevé l'étude ont utilisé au moins 80 % de leurs
médicaments, et ces nombres ne différaient pas entre les deux
groupes. Enfin, certaines données étaient manquantes, mais leur
imputation n'a produit aucune différence substantielle dans les
résultats globaux.
Les taux de testostérone libre et biodisponible étaient
calculés à partir des concentrations totales de
testostérone, de SHBG et d'albumine. Cette méthode semble
rapide, abordable, simple, fiable, et adaptée à la pratique
clinique, bien que non idéale comparé à la dialyse
à l'équilibre.
L'augmentation de la masse maigre et la diminution de la masse grasse dans
cette étude sont comparables à celles rapportées dans la
plupart des autres études sur la supplémentation en
testostérone chez des hommes
hypogonadiques.39
Aucun effet n'a été observé sur l'indice de masse
corporelle et sur le tour de taille, ni sur les masses grasses
sous-cutanée et intra-abdominale mesurées par échographie
; ceci s'explique probablement par le fait que ces mesures ne sont pas
suffisamment sensibles pour détecter de faibles variations. Dans cette
étude, l'augmentation de la masse maigre n'était pas
accompagnée d'une augmentation de la force musculaire ou de la
capacité fonctionnelle. La force musculaire est un facteur clé
dans la préservation de l'indépendance chez les personnes
âgées, tandis que sa diminution constitue un facteur de risque de
chutes, de fragilité, et
d'invalidité.40,41
Des études épidémiologiques observationnelles ont
démontré une association non seulement entre les taux de
testostérone et la masse et la force musculaires, mais également
entre ces taux, la performance physique et le risque de
chutes.42,43
Néanmoins, dans d'autres études sur la supplémentation en
testostérone, les effets de l'augmentation de la masse maigre sur la
force supplémentation en testostérone chez les hommes
âgés en bonne santé pouvait induire une augmentation
modérée de la force musculaire, mais la taille d'effet moyenne
était fortement influencée par 1 étude. Peu
d'études ont précédemment évalué les effets
de la supplémentation en testostérone sur la capacité
fonctionnelle.3,45
La diminution de la masse grasse était également
associée à une réduction de la glycémie et
à une augmentation de l'insulinorésistance. D'autres
études sur la supplémentation en testostérone ont
également démontré une diminution de la glycémie,
de l'insulinémie, et du taux moyen d'hémoglobine glyquée,
ainsi qu'une augmentation de la sensibilité à l'insuline ;
cependant, ces données étaient essentiellement basées sur
des individus avec un diabète de type 2 ou une obésité
abdominale.46,47
Il n'existe pratiquement pas d'étude bien conçue sur les effets
de la supplémentation en testostérone sur
l'insulinorésistance, chez des hommes âgés en bonne
santé, comparables aux participants de cette étude.
La diminution de la masse grasse était également
accompagnée d'une réduction du cholestérol total,
essentiellement due à une diminution du HDL-cholestérol. La
testostérone exogène augmente l'activité de la lipase
hépatique, enzyme impliquée dans le catabolisme du
HDL,48 ce
qui devrait réduire les taux de HDL ; cependant les données
disponibles sont contradictoires. Deux récentes méta-analyses
sont parvenues à des résultats divergents ; dans l'une,
l'administration de testostérone par voie intramusculaire chez des
hommes hypogonadiques produisait une faible réduction
dose-dépendante du HDL-C et des diminutions simultanées du
cholestérol total et du LDL-C49 ; dans l'autre, le cholestérol
total diminuait après administration de testostérone (par voie
orale, intramusculaire ou transdermique) chez des hommes agonadiques ou
hypogonadiques. Cependant, le HDL-C n'était réduit que dans les
études avec des taux de testostérone prétraitement plus
élevés,39
et les effets sur le HDL-C étaient inférieurs dans les
études utilisant des esters de testostérone par voie
intramusculaire comparé à celles utilisant de la
testostérone orale et transdermique. Ceci s'accorde avec notre
étude et pourrait refléter des taux sériques
supérieurs d'oestradiol, liés à la testostérone
intramusculaire, dont le rôle est majeur dans le maintien des taux de
HDL-cholestérol chez les hommes, pour contrer les effets de la
testostérone sur l'activité de la lipoprotéine
lipase.48
Le syndrome métabolique est un facteur de risque majeur de maladie
cardiovasculaire et de diabète de type
2,50,51
et des études épidémiologiques ont démontré
son association avec un taux d'androgène
bas.52-54
Cependant, aucune étude n'a évalué les effets de la
supplémentation en testostérone sur le syndrome
métabolique. Nous avons trouvé une augmentation non
significative du pourcentage d'hommes répondant aux critères de
ce syndrome, principalement causé par la diminution des taux de
HDL-cholestérol. Les effets de ces variations sur le risque de maladie
cardiovasculaire et le diabète de type 2 restent
indéterminés.
En avançant en âge, les hommes perdent de la densité
minérale osseuse, ce qui majore le risque de fractures. Jusqu'à
20 % des hommes avec des fractures
vertébrales55
et 50 % des hommes avec des fractures de hanche56 ont des paramètres
biochimiques d'hypogonadisme, suggérant un rôle potentiel de la
supplémentation en testostérone dans la prévention. Dans
cette étude, la supplémentation en testostérone n'avait
aucun effet sur la densité minérale osseuse, bien que la
période d'intervention ait été trop courte pour
détecter toute variation dans le renouvellement osseux. Deux
méta-analyses ont démontré que la supplémentation
en testostérone, en particulier la testostérone intramusculaire,
augmente modérément la densité osseuse du rachis lombaire
chez les hommes, après un minimum de 12 à 36 mois de traitement,
mais les résultats au niveau du col fémoral sont peu
concluants.39,57
Cependant, aucune de ces études n'a démontré de
réduction du taux de fractures sous traitement par
testostérone.
La prévalence du déclin cognitif associé à
l'âge dans la population générale d'âge
avancé est estimée entre 20 % et 35 %.58 Le déclin
cognitif peut précéder la démence et le placement
consécutif en institution. Des études
épidémiologiques ont rapporté une association positive
entre le taux de testostérone et la
cognition,59-62
et entre le taux de testostérone et l'incidence de maladie
d'Alzheimer.60,63,64
En outre, des données de la recherche fondamentale et d'études
chez l'animal suggèrent que la testostérone exerce un effet
protecteur sur la fonction
cognitive.65-67
Cependant, dans notre étude, la supplémentation en
testostérone n'avait pas d'effet sur la fonction cognitive, et d'autres
études ont trouvé des résultats
similaires.2,31,33,68
Même les capacités visuo-spatiales, testées par un test
visuo-spatial sensible et largement utilisé (performance de rotation
mentale), ne présentaient aucune amélioration avec la
supplémentation en testostérone. Cependant, nous n'avons pu
exclure qu'un effet supérieur à environ 0,2 écarts-types
de la distribution initiale du test visuospatial ; si les effets
inférieurs sont considérés comme cliniquement pertinents,
des études plus vastes doivent être menées.
La plupart des participants de cette étude ne présentaient
pas d'anomalies cognitives préexistantes ; cependant, les scores
obtenus se situaient entre le 50ème et le 70ème percentile pour
tous les tests cognitifs, suggérant l'absence d'effet plafond. En
outre, même les études sur la supplémentation en
testostérone chez des hommes présentant un léger
déficit cognitif ou la maladie d'Alzheimer ont
révélé des résultats
mitigés.34,69,70
Il a été suggéré que la réduction des
taux de testostérone liée à l'âge affectait
défavorablement la qualité de
vie.71
Cependant, la plupart des études, dont la nôtre, évaluant
la perception de la qualité de vie liée à la santé
avec le SF-36 n'ont pas démontré de bénéfice du
traitement45,72
; cela pourrait être dû au manque de sensibilité de ce
questionnaire. Dans notre étude, nous avons également
utilisé un questionnaire élaboré pour évaluer la
qualité de vie liée au déficit hormonal, et avons
trouvé des résultats bénéfiques modestes dans une
partie du questionnaire, en particulier sur l'item de «
résilience ou tolérance au stress ». Même avec cette
différence significative, les comparaisons multiples impliquées
ne soutiennent pas un effet majeur sur la qualité de vie.
Le fait que les hommes recevant un traitement hormonal de substitution
pourraient être exposés à des risques médicaux
majorés suscite de graves inquiétudes. Les effets
indésirables connus de la substitution androgénique sont la
gynécomastie, l'oedème, et une augmentation de
l'hématocrite. Cependant, le problème majeur de ce traitement
à l'âge avancé réside dans le risque de
développement et/ou de progression de maladies prostatiques comme
l'hyperplasie bénigne de la prostate et le cancer de la prostate. Deux
études
récentes73,74
n'ont démontré aucune augmentation des problèmes
médicaux liés à la prostate, mais plusieurs observations
ont suggéré que le traitement par testostérone pourrait
transformer le cancer occulte de la prostate en une lésion cliniquement
symptomatique.75,76
Dans notre étude, rien n'indiquait que la testostérone pouvait
stimuler un cancer occulte de la prostate. Une revue systématique a
conclu que le traitement substitutif par testostérone chez les hommes
hypogonadiques augmentait les taux de PSA d'une moyenne de 0,30 ng/ml chez les
hommes jeunes et de 0,43 ng/ml chez les plus
âgés.77
Dans la présente étude, nous n'avons trouvé aucun effet
global sur le taux sérique de PSA, le volume de la prostate et les
symptômes mictionnels. Un effet activateur de la testostérone sur
l'érythropoïèse a été documenté dans
plusieurs
études.73
Cet effet a été confirmé dans notre étude, mais
sans conséquences cliniques apparentes. La fonction hépatique et
les événements indésirables (graves) ne
différaient pas significativement entre les groupes, bien que la
créatinine ait présenté une augmentation à la
limite de la significativité statistique. Cependant, la durée de
cette étude n'était que de 6 mois, et une étude plus
vaste serait nécessaire pour établir l'innocuité du
traitement.
À notre connaissance, il s'agit ici de la plus vaste étude
menée sur la supplémentation en testostérone, avec le
plus grand nombre de critères de jugement et un plan randomisé
en double aveugle. L'observance était élevée, et le taux
d'abandon faible. Nous avons noté une modification de la composition
corporelle, qui était associée à différents effets
sur les facteurs de risques métaboliques ; en revanche, aucun effet
bénéfique n'a été observé sur la
capacité fonctionnelle, la densité minérale osseuse, ou
la fonction cognitive. Une sous-partie du questionnaire sur la qualité
de vie liée au déficit hormonal a révélé
une amélioration dans le groupe de traitement par testostérone.
Au regard de plusieurs indicateurs de santé et de capacité
fonctionnelle et cognitive, les résultats de cette étude ne
soutiennent pas de bénéfice global de la supplémentation
en testostérone chez des hommes en bonne santé avec des taux
circulants de testostérone dans la limite inférieure de la
normale, sur une période de 6 mois.
Informations sur les auteurs
Corresponding Author: Marielle H. Emmelot-Vonk, MD, University Medical
Center Utrecht, PO Box 85500, Room B05.256, 3508 GA Utrecht, the Netherlands
(m.h.emmelotvonk{at}umcutrecht.nl).
Contributions des auteurs: Le Dr van der Schouw a eu un accès
complet à toutes les données de l'étude et accepte la
responsabilité de l'intégrité des données et de
l'exactitude de l'analyse des données.
Conception et schéma de l'étude: Verhaar, Grobbee,
van der Schouw.
Recueil des données: Emmelot-Vonk, Nakhai Pour, Lock, van
der Schouw.
Analyse et interpretation des données: Emmelot-Vonk,
Verhaar, Nakhai Pour, Aleman, Lock, Bosch, Grobbee, van der Schouw.
Rédaction du manuscrit: Emmelot-Vonk, van der Schouw.
Revue critique du manuscrit: Verhaar, Nakhai Pour, Aleman, Lock,
Bosch, Grobbee, van der Schouw.
Analayse statistique: Emmelot-Vonk.
Obtention du financement: Verhaar, Grobbee, van der Schouw.
Aide administrative, technique ou matérielle: Emmelot-Vonk,
Nakhai Pour, Aleman, Lock.
Supervision de l'étude: Verhaar, Grobbee, van der
Schouw.
Liens financiers: Aucun déclaré.
Financement/Soutien: Cette étude a
bénéficié d'un soutien sous la forme d'une bourse
014-91-063 du Netherlands Organization for Health Research and Development. Le
médicament à l'essai était fourni par Organon NV (Oss,
Pays-Bas).
Rôle du sponsor: Le Netherlands Organization for Health
Research and Development et Organon NV n'ont joué aucun rôle dans
le schéma et la conduite de l'étude, le recueil, la gestion,
l'analyse et l'interprétation des données, la
préparation, la revue ou l'approbation du manuscrit.
Author Affiliations: Departments of Geriatric Medicine and
Urology, Julius Center for Health Sciences and Primary Care, University
Medical Center Utrecht, Utrecht, the Netherlands; and BCN Neuroimaging Center,
University of Groningen, Groningen, the Netherlands.
BIBLIOGRAPHIE
 |  |
1. Harman SM, Metter EJ, Tobin JD, Pearson J, Blackman MR.
Longitudinal effects of aging on serum total and free testosterone levels in
healthy men: Baltimore Longitudinal Study of Aging. J Clin
Endocrinol Metab.2001; 86(2):724
-731.
FREE FULL TEXT
2. Sih R, Morley JE, Kaiser FE, Perry HM III, Patrick P, Ross C.
Testosterone replacement in older hypogonadal men: a 12-month randomized
controlled trial. J Clin Endocrinol Metab.1997; 82(6):1661
-1667.
FREE FULL TEXT
3. Snyder PJ, Peachey H, Hannoush P, et al. Effect of testosterone
treatment on body composition and muscle strength in men over 65 years of age.
J Clin Endocrinol Metab.1999; 84(8):2647
-2653.
FREE FULL TEXT
4. Tenover JS. Effects of testosterone supplementation in the aging
male. J Clin Endocrinol Metab.1992; 75(4):1092
-1098.
ABSTRACT
5. Kenny AM, Prestwood KM, Gruman CA, Marcello KM, Raisz LG. Effects
of transdermal testosterone on bone and muscle in older men with low
bioavailable testosterone levels. J Gerontol A Biol Sci Med
Sci.2001; 56(5):M266
-M272.
FREE FULL TEXT
6. Committee on Assessing the Need for Clinical Trials of
Testosterone. Concluding remarks. In: Liverman CT, Blazer DG, eds.
Replacement Therapy: Testosterone and Aging: Clinical Research
Directions. Washington, DC: National Academies Press;2004
.7. Nakhai Pour HR, Emmelot-Vonk MH, Sukel-Helleman M, Verhaar HJ,
Grobbee DE, van der Schouw YT. Double blind randomized placebo-controlled
trial on the effects of testosterone supplementation in elderly men with
moderate-to-low testosterone levels: design and baseline characteristics
[ISRCTN23688581]. Trials.2006; 7:24
.
PUBMED
8. Podsiadlo D, Richardson S. The timed "up & go": a
test of basic functional mobility for frail elderly persons. J Am
Geriatr Soc.1991; 39(2):142
-148.
PUBMED
9. Siegert CE, Vleming LJ, Vandenbroucke JP, Cats A. Measurement of
disability in Dutch rheumatoid arthritis patients. Clin
Rheumatol.1984; 3(3):305
-309.
PUBMED
10. Hamilton A, Balnave R, Adams R. Grip strength testing reliability.
J Hand Ther.1994; 7(3):163
-170.
PUBMED
11. Samson MM, Meeuwsen IB, Crowe A, Dessens JA, Duursma SA, Verhaar
HJ. Relationships between physical performance measures, age, height and body
weight in healthy adults. Age Ageing.2000; 29(3):235
-242.
FREE FULL TEXT
12. Lezak MD. Neuropsychologial Assesment. New
York, NY: Oxford University Press; 1995.13. Wechsler D. A standardized memory scale for clinical use.
J Psychol.1945; 19:27
-95.
14. Reitan RM, Wolfson D. The Halstead-Reitan
Neuropsychological Test Battery. Tucson, AZ: Neuropsychological
Press; 1985.15. Benton AL, Hamsher KS, Varney NR, Spreen O. Contribution
to Neuropsychological Assessment. New York, NY: Oxford University
Press; 1983..16. Vandenberg SG, Kuse AR. Mental rotations, a group test of
three-dimensional spatial visualization. Percept Mot
Skills.1978; 47(2):599
-604.
PUBMED
17. Silverman I, Kastuk D, Choi J, Phillips K. Testosterone levels and
spatial ability in men. Psychoneuroendocrinology.1999; 24(8):813
-822.
PUBMED
18. Vermeulen A, Verdonck L, Kaufman JM. A critical evaluation of
simple methods for the estimation of free testosterone in serum. J
Clin Endocrinol Metab1999; 84(10):3666
-3672.
FREE FULL TEXT
19. Tremblay AJ, Morrissette H, Gagne JM, Bergeron J, Gagne C, Couture
P. Validation of the Friedewald formula for the determination of low-density
lipoprotein cholesterol compared with beta-quantification in a large
population. Clin Biochem.2004; 37(9):785
-790.
PUBMED
20. Hrebícek J, Janout V, Malincikova J, Horakova D, Cizek L.
Detection of insulin resistance by simple quantitative insulin sensitivity
check index QUICKI for epidemiological assessment and prevention. J
Clin Endocrinol Metab.2002; 87(1):144
-147.
FREE FULL TEXT
21. Katz A, Nambi SS, Mather K, et al. Quantitative insulin sensitivity
check index: a simple, accurate method for assessing insulin sensitivity in
humans. J Clin Endocrinol Metab.2000; 85(7):2402
-2410.
FREE FULL TEXT
22. Bonora E, Targher G, Alberiche M, et al. Homeostasis model
assessment closely mirrors the glucose clamp technique in the assessment of
insulin sensitivity: studies in subjects with various degrees of glucose
tolerance and insulin sensitivity. Diabetes Care2000; 23(1):57
-63.
ABSTRACT
23. Executive Summary of the Third Report of The National Cholesterol
Education Program (NCEP) Expert Panel on Detection. Evaluation, And Treatment
of High Blood Cholesterol In Adults (Adult Treatment Panel III).
JAMA.2001; 285(19):2486
-2497.
FREE FULL TEXT
24. Ware JE Jr, Sherbourne CD. The MOS 36-item Short-Form Health Survey
(SF-36), I: conceptual framework and item selection. Med
Care.1992; 30(6):473
-483.
PUBMED
25. Huber D, Henrich G, Herschbach P. Measuring the quality of life: a
comparison between physically and mentally chronically ill patients and
healthy persons. Pharmacopsychiatry.1988; 21(6):453
-455.
PUBMED
26. Herschbach P, Henrich G, Strasburger CJ, et al. Development and
psychometric properties of a disease-specific quality of life questionnaire
for adult patients with growth hormone deficiency. Eur J
Endocrinol.2001; 145(3):255
-265.
ABSTRACT
27. Rhodes T, Girman CJ, Jacobsen SJ, Roberts RO, Guess HA, Lieber MM.
Longitudinal prostate growth rates during 5 years in randomly selected
community men 40 to 79 years old. J Urol.1999; 161(4):1174
-1179.
PUBMED
28. Lee F, Gray JM, McLeary RD, et al. Transrectal ultrasound in the
diagnosis of prostate cancer: location, echogenicity, histopathology, and
staging. Prostate.1985; 7(2):117
-129.
PUBMED
29. Badía X, Garcia-Losa M, Dal Re R. Ten-language translation
and harmonization of the International Prostate Symptom Score: developing a
methodology for multinational clinical trials. Eur
Urol.1997; 31(2):129
-140.
PUBMED
30. Nieschlag E, Swerdloff R, Behre HM, et al. Investigation,
treatment, and monitoring of late-onset hypogonadism in males: ISA, ISSAM, and
EAU recommendations. J Androl.2006; 27(2):135
-137.
FREE FULL TEXT
31. Cherrier MM, Asthana S, Plymate S, et al. Testosterone
supplementation improves spatial and verbal memory in healthy older men.
Neurology.2001; 57(1):80
-88.
FREE FULL TEXT
32. Ferrando AA, Sheffield-Moore M, Yeckel CW, et al. Testosterone
administration to older men improves muscle function: molecular and
physiological mechanisms. Am J Physiol Endocrinol
Metab.2002; 282(3):E601
-E607.
FREE FULL TEXT
33. Janowsky JS, Oviatt SK, Orwoll ES. Testosterone influences spatial
cognition in older men. Behav Neurosci.1994; 108(2):325
-332.
PUBMED
34. Cherrier MM, Matsumoto AM, Amory JK, et al. Testosterone improves
spatial memory in men with Alzheimer disease and mild cognitive impairment.
Neurology.2005; 64(12):2063
-2068.
FREE FULL TEXT
35. Wittert GA, Chapman IM, Haren MT, Mackintosh S, Coates P, Morley
JE. Oral testosterone supplementation increases muscle and decreases fat mass
in healthy elderly males with low-normal gonadal status. J Gerontol
A Biol Sci Med Sci.2003; 58(7):618
-625.
PUBMED
36. Park NC, Yan BQ, Chung JM, Lee KM. Oral testosterone undecanoate
(Andriol) supplement therapy improves the quality of life for men with
testosterone deficiency. Aging Male.2003; 6(2):86
-93.
PUBMED
37. Schnabel PG, Bagchus W, Lass H, Thomsen T, Geurts TB. The effect of
food composition on serum testosterone levels after oral administration of
Andriol Testocaps. Clin Endocrinol (Oxf).2007; 66(4):579
-585.
PUBMED
38. Houwing NS, Maris F, Schnabel PG, Bagchus WM. Pharmacokinetic study
in women of three different doses of a new formulation of oral testosterone
undecanoate, Andriol Testocaps. Pharmacotherapy.2003; 23(10):1257
-1265.
PUBMED
39. Isidori AM, Giannetta E, Greco EA, et al. Effects of testosterone
on body composition, bone metabolism and serum lipid profile in middle-aged
men: a meta-analysis. Clin Endocrinol (Oxf).2005; 63(3):280
-293.
PUBMED
40. Morley JE, Baumgartner RN, Roubenoff R, Mayer J, Nair KS.
Sarcopenia. J Lab Clin Med.2001; 137(4):231
-243.
PUBMED
41. Bhasin S, Tenover JS. Age-associated sarcopenia—issues in the
use of testosterone as an anabolic agent in older men. J Clin
Endocrinol Metab.1997; 82(6):1659
-1660.
FREE FULL TEXT
42. Orwoll E, Lambert LC, Marshall LM, et al. Endogenous testosterone
levels, physical performance, and fall risk in older men. Arch
Intern Med.2006; 166(19):2124
-2131.
FREE FULL TEXT
43. Schaap LA, Pluijm SM, Smit JH, et al. The association of sex
hormone levels with poor mobility, low muscle strength and incidence of falls
among older men and women. Clin Endocrinol (Oxf).2005; 63(2):152
-160.
PUBMED
44. Ottenbacher KJ, Ottenbacher ME, Ottenbacher AJ, Acha AA, Ostir GV.
Androgen treatment and muscle strength in elderly men: a meta-analysis.
J Am Geriatr Soc.2006; 54(11):1666
-1673.
PUBMED
45. Ly LP, Jimenez M, Zhuang TN, Celermajer DS, Conway AJ, Handelsman
DJ. A double-blind, placebo-controlled, randomized clinical trial of
transdermal dihydrotestosterone gel on muscular strength, mobility, and
quality of life in older men with partial androgen deficiency. J
Clin Endocrinol Metab.2001; 86(9):4078
-4088.
FREE FULL TEXT
46. Boyanov MA, Boneva Z, Christov VG. Testosterone supplementation in
men with type 2 diabetes, visceral obesity and partial androgen deficiency.
Aging Male.2003; 6(1):1
-7.
PUBMED
47. Kapoor D, Goodwin E, Channer KS, Jones TH. Testosterone replacement
therapy improves insulin resistance, glycaemic control, visceral adiposity and
hypercholesterolaemia in hypogonadal men with type 2 diabetes. Eur
J Endocrinol.2006; 154(6):899
-906.
FREE FULL TEXT
48. Zmuda JM, Fahrenbach MC, Younkin BT, et al. The effect of
testosterone aromatization on high-density lipoprotein cholesterol level and
postheparin lipolytic activity. Metabolism.1993; 42(4):446
-450.
PUBMED
49. Whitsel EA, Boyko EJ, Matsumoto AM, Anawalt BD, Siscovick DS.
Intramuscular testosterone esters and plasma lipids in hypogonadal men: a
meta-analysis. Am J Med.2001; 111(4):261
-269.
PUBMED
50. Scuteri A, Najjar SS, Morrell CH, Lakatta EG. The metabolic
syndrome in older individuals: prevalence and prediction of cardiovascular
events: the Cardiovascular Health Study. Diabetes
Care.2005; 28(4):882
-887.
FREE FULL TEXT
51. Lakka HM, Laaksonen DE, Lakka TA, et al. The metabolic syndrome and
total and cardiovascular disease mortality in middle-aged men.
JAMA.2002; 288(21):2709
-2716.
FREE FULL TEXT
52. Laaksonen DE, Niskanen L, Punnonen K, et al. Testosterone and sex
hormone-binding globulin predict the metabolic syndrome and diabetes in
middle-aged men. Diabetes Care.2004; 27(5):1036
-1041.
FREE FULL TEXT
53. Schatzl G, Madersbacher S, Thurridl T, et al. High-grade prostate
cancer is associated with low serum testosterone levels.
Prostate.2001; 47(1):52
-58.
PUBMED
54. Kupelian V, Page ST, Araujo AB, Travison TG, Bremner WJ, McKinlay
JB. Low sex hormone-binding globulin, total testosterone, and symptomatic
androgen deficiency are associated with development of the metabolic syndrome
in nonobese men. J Clin Endocrinol Metab.2006; 91(3):843
-850.
FREE FULL TEXT
55. Baillie SP, Davison CE, Johnson FJ, Francis RM. Pathogenesis of
vertebral crush fractures in men. Age Ageing.1992; 21(2):139
-141.
FREE FULL TEXT
56. Stanley HL, Schmitt BP, Poses RM, Deiss WP. Does hypogonadism
contribute to the occurrence of a minimal trauma hip fracture in elderly men?
J Am Geriatr Soc.1991; 39(8):766
-771.
PUBMED
57. Tracz MJ, Sideras K, Bolona ER, et al. Testosterone use in men and
its effects on bone health: a systematic review and meta-analysis of
randomized placebo-controlled trials. J Clin Endocrinol
Metab.2006; 91(6):2011
-2016.
FREE FULL TEXT
58. Hanninen T, Koivisto K, Reinikainen KJ, et al. Prevalence of
ageing-associated cognitive decline in an elderly population. Age
Ageing.1996; 25(3):201
-205.
FREE FULL TEXT
59. Barrett-Connor E, Goodman-Gruen D, Patay B. Endogenous sex hormones
and cognitive function in older men. J Clin Endocrinol
Metab.1999; 84(10):3681
-3685.
FREE FULL TEXT
60. Muller M, Aleman A, Grobbee DE, de Haan EH, van der Schouw YT.
Endogenous sex hormone levels and cognitive function in aging men: is there an
optimal level? Neurology.2005; 64(5):866
-871.
FREE FULL TEXT
61. Moffat SD, Zonderman AB, Metter EJ, Blackman MR, Harman SM, Resnick
SM. Longitudinal assessment of serum free testosterone concentration predicts
memory performance and cognitive status in elderly men. J Clin
Endocrinol Metab.2002; 87(11):5001
-5007.
FREE FULL TEXT
62. Yaffe K, Lui LY, Zmuda J, Cauley J. Sex hormones and cognitive
function in older men. J Am Geriatr Soc.2002; 50(4):707
-712.
PUBMED
63. Janowsky JS. The role of androgens in cognition and brain aging in
men. Neuroscience.2006; 138(3):1015
-1020.
PUBMED
64. Moffat SD, Zonderman AB, Metter EJ, et al. Free testosterone and
risk for Alzheimer disease in older men. Neurology.2004; 62(2):188
-193.
FREE FULL TEXT
65. Papasozomenos SC, Shanavas A. Testosterone prevents the heat
shock-induced overactivation of glycogen synthase kinase-3 beta but not of
cyclin-dependent kinase 5 and c-Jun NH2-terminal kinase and concomitantly
abolishes hyperphosphorylation of tau: implications for Alzheimer's disease.
Proc Natl Acad Sci U S A.2002; 99(3):1140
-1145.
FREE FULL TEXT
66. Tirassa P, Thiblin I, Agren G, Vigneti E, Aloe L, Stenfors C.
High-dose anabolic androgenic steroids modulate concentrations of nerve growth
factor and expression of its low affinity receptor (p75-NGFr) in male rat
brain. J Neurosci Res.1997; 47(2):198
-207.
PUBMED
67. Gouras GK, Xu H, Gross RS, et al. Testosterone reduces neuronal
secretion of Alzheimer's beta-amyloid peptides. Proc Natl Acad Sci
U S A.2000; 97(3):1202
-1205.
FREE FULL TEXT
68. Haren MT, Wittert GA, Chapman IM, Coates P, Morley JE. Effect of
oral testosterone undecanoate on visuospatial cognition, mood and quality of
life in elderly men with low-normal gonadal status.
Maturitas.2005; 50(2):124
-133.
PUBMED
69. Kenny AM, Fabregas G, Song C, Biskup B, Bellantonio S. Effects of
testosterone on behavior, depression, and cognitive function in older men with
mild cognitive loss. J Gerontol A Biol Sci Med Sci.2004; 59(1):75
-78.
PUBMED
70. Lu PH, Masterman DA, Mulnard R, et al. Effects of testosterone on
cognition and mood in male patients with mild Alzheimer disease and healthy
elderly men. Arch Neurol.2006; 63(2):177
-185.
FREE FULL TEXT
71. Moncada I. Testosterone and men's quality of life. Aging
Male.2006; 99(4):189
-193.
PUBMED
72. Kenny AM, Bellantonio S, Gruman CA, Acosta RD, Prestwood KM.
Effects of transdermal testosterone on cognitive function and health
perception in older men with low bioavailable testosterone levels.
J Gerontol A Biol Sci Med Sci.2002; 57(5):M321
-M325.
FREE FULL TEXT
73. Rhoden EL, Morgentaler A. Risks of testosterone-replacement therapy
and recommendations for monitoring. N Engl J Med.2004; 350(5):482
-492.
PUBMED
74. Marks LS, Mazer NA, Mostaghel E, et al. Effect of testosterone
replacement therapy on prostate tissue in men with late-onset hypogonadism: a
randomized controlled trial. JAMA.2006; 296(19):2351
-2361.
FREE FULL TEXT
75. Curran MJ, Bihrle W III. Dramatic rise in prostate-specific antigen
after androgen replacement in a hypogonadal man with occult adenocarcinoma of
the prostate. Urology.1999; 53(2):423
-424.
PUBMED
76. Gaylis FD, Lin DW, Ignatoff JM, Amling CL, Tutrone RF, Cosgrove DJ.
Prostate cancer in men using testosterone supplementation. J
Urol.2005; 174(2):534
-538.
PUBMED
77. Bhasin S, Singh AB, Mac RP, Carter B, Lee MI, Cunningham GR.
Managing the risks of prostate disease during testosterone replacement therapy
in older men: recommendations for a standardized monitoring plan. J
Androl.2003; 24(3):299
-311.
FREE FULL TEXT
ARTICLE EN RAPPORT
Cette semaine dans le JAMA
JAMA. 2008;299:9.
Texte Complet
|